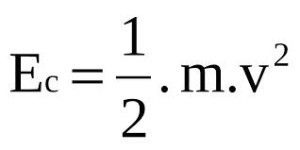En nuestra vida estamos rodeados por aparatos eléctricos y magnéticos, pero ¿alguna vez te preguntaste si éstos estaban relacionados de alguna forma? La respuesta es sí, la electricidad y el magnetismo están íntimamente relacionados. Su relación fue descubierta hace muchos años y ha permitido realizar artefactos realmente complejos.
Diferencias:
- Las cargas eléctricas pueden estar aisladas (positivas y negativas), mientras que en los imanes nunca se encuentra un polo sur o un polo norte aislado, siempre se encuentran en polos magnéticos.
- Las cargas eléctricas se transmiten por medio de la frotación, mientras que no es necesario frotar los imanes para que transmitan sus propiedades.
- Si se quiere descargar un cuerpo cargado eléctricamente es necesario conectarlo a un cable a tierra, mientras que si se le quiere quitar el magnetismo a un imán hay que calentarlo en exceso.
Semejanzas:
- Los polos opuestos se atraen y los polos similares se repelen.
- Cuando un cuerpo esta cargado o magnetizado puede transmitir estas propiedades eléctricas y magnéticas a otros materiales.
- Cuando varia el campo magnético se produce un campo eléctrico, y viceversa.
RELACIÓN ENTRE LA ELECTRICIDAD Y EL MAGNETISMO
En año 1819, el danés Hans Christian Orested fue el primero en relacionar los imanes con las corrientes eléctricas. Orested observó que cuando una aguja imantada se acercaba paralelamente a un conductor eléctrico y se hacia circular corriente, la aguja cambiaba de dirección. Este hecho fue el que dio origen a lo que hoy se conoce como electromagnetismo.
Campo electromagnético
El campo electromagnético se genera cuando se combinan las fuerzas de un imán con las de la electricidad. Una de sus características es que atrae todo lo que está en su rango.
Desde el inicio de la era industrial, el consumo de energía proveniente de los combustibles fósiles -carbón, petróleo y gas natural- ha ido en aumento. La sociedad, tal y como la conocemos hasta ahora, está basada en estas fuentes de energía y en ellas hemos basado nuestra economía. Pero la quema de los combustibles fósiles es la responsable de la producción de los gases de efecto invernadero, causantes del calentamiento global.
Aumento del nivel del mar, sequías cada vez más severas, fenómenos meteorológicos extremos, son algunas de las consecuencias del cambio climático y que ya se han empezado a manifestar. España, además, es uno de los países más vulnerables al cambio climático. El medio ambiente, la sociedad, la economía y, por tanto, el empleo, se verán afectados por el calentamiento global. Sin embargo, España se aleja cada vez más del cumplimiento del Protocolo de Kioto, el único acuerdo internacional de lucha contra el cambio climático.
La única forma de detener el cambio climático pasa por cambiar nuestros patrones de consumo. Es imprescindible producir más con menos, aumentar la eficiencia energética de todos los procesos y sustituir el consumo de energías fósiles por renovables. Hacen falta políticas que incentiven el ahorro y la eficiencia energética.
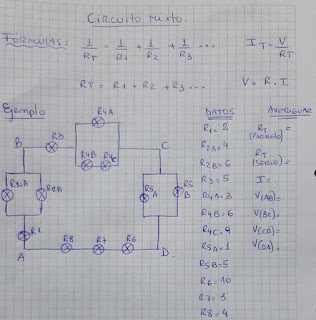
1)
Describe las partes de un circuito
2)
En qué se diferencia la intensidad en el
circuito simple y paralelo
3)
Enuncia 3 diferencias del circuito simple y paralelo
(Ej: si se quita una resistencia que pasa entre 1 y otro…pensar otras que hemos
conversado)
4)
¿A qué se denomina electricidad?
5)
Describe como es recomendable resolver un
circuito mixto
6)
¿Cómo se verifica tanto en el circuito simple
como el paralelo si el ejercicio está correcto?
7)
¿Cuál es el circuito más recomendado para las
viviendas? ¿Por qué?
8)
Describe 3 partes de la forma de cómo llega la
electricidad a las casas….
9)
¿El Voltaje desde que se obtiene la energía y
llega a los hogares es siempre el mismo? ¿Por qué?
10) Si
la resistencia 1 vale 3 y la resistencia 2 vale 6, es un circuito paralelo, ¿cuánto
vale la resistencia total?
11) Enuncia
3 energías renovables que existan. ¿En qué se diferencian con la energía no
renovable?
12) Si
en un segmento A-B hay resistencia 1 que vale 4 y una resistencia 2 que vale 2,
suponiendo que la Intensidad vale 20... ¿Cuánto vale el voltaje entre AB?
13) ¿Cuál
es la función de un disyuntor en una casa?
14) Si
el voltaje vale 100 y la resistencia total vale 20, explica cómo calcular la
intensidad
15) ¿Explicar
según la teoría que es la intensidad y que es el voltaje?... ¿Es lo mismo?
16) ¿Es
importante el interruptor o puede faltar? ¿Qué partículas viajan por los
conductores?
17) ¿Hay
materiales aislantes?, explica 2 de ellos
18) ¿A
qué se llama materiales buenos conductores?
19) La
intensidad no es la misma en un circuito en serie que en uno paralelo. ¿Por
qué?
20) ¿En
un circuito combinado la intensidad es una sola?
Las puedo repetir o no, recuerden que puedo cambiar la pregunta, pero siempre desde estos temas…Nos vemos mañana en el zoom, les dejo el link del encuentro:
Cómo charlamos la clase pasada por zoom empezamos a trabajar
energía para ello es importante que realicen el siguiente trabajo práctico en
la carpeta, haremos una puesta en común el jueves y presentaré energía mecánica
en vivo, por eso es importante que todos participen…
1) 1. ¿A qué se denomina energía renovable y no
renovable?
2) 2. Detalla y explica brevemente los tipos de
energías renovables que hay…
3) 3. Enuncie 3 ejemplos donde la energía se
transforme
4) 4. ¿Es lo mismo calor y temperatura?
Seguimos practicando la estequiometria, pero ahora con cálculos sencillos basados con regla de 3 simple. A copiar en la carpeta e intentar resolverlos y el jueves en el zoom respondo dudas.
Vamos a seguir practicando ejercicios haciendo estequiometría. Hacer calculo de moles, moléculas y masa en gramos.
El día jueves los vamos a corregir. Atención balancear el ejercicio 2 y 4 antes de hacer los cálculos.
Equipo 2:
Alumnos: Álvarez, Vazquez, Luca, Zayas.
Tema: Lípidos
Fecha de exposición x zoom: 30/9
Equipo 3:
Alumnos: Cáceres, Peñarol, Aguirre, Molina y Scotto.
Tema: Proteínas
Fecha de exposición x zoom: 7/10
Equipo 4:
Alumnos: Gonzalez, Vargas,Patiño y Ricci.
Tema: Frutas y verduras
Fecha de exposición x zoom: 14/10
Equipo 5:
Alumnos: López Ezequiel, Dominguez, Ramirez y Suarez.
Tema: Tipos de conservas.
Fecha de exposición x zoom: 21/10
Equipo 6:
Alumnos: Avdeichuk, Knaus, Lezcano y Mollo.
Tema. Aditivos y conservantes
Fecha de exposición x zoom: 28/10
Actividad para investigar y enviar vía mail a gisellabarua@hotmail.com
1) Por qué es importante la respiración celular en el metabolismo?
2) Explica la respiración celular brevemente.
Fecha máxima de entrega 29 de Septiembre
___________________________________________________________________________
La estequiometría se encarga de estudiar las relaciones cuantitativas existentes entre elementos y compuestos, cuando experimentan cambios químicos. Las reacciones químicas, no son más que la transformación de una o más sustancias en otra u otras sustancias nuevas con características químicas y físicas distintas a las sustancias que le dieron origen. Las transformaciones de sustancias que ocurren en una reacción química pueden representarse mediante símbolos y fórmulas, es decir, mediante lo que se denomina ECUACIÓN QUÍMICA
Ahora estudiaremos la estequiometría, es decir la medición de los elementos.
Las transformaciones que ocurren en una reacción química se rigen por la Ley de la conservación de la masa: Los átomos no se crean ni se destruyen durante una reacción química.
Entonces, el mismo conjunto de átomos está presente antes, durante y después de la reacción. Los cambios que ocurren en una reacción química simplemente consisten en una re ordenación de los átomos.
Por lo tanto una ecuación química ha de tener el mismo número de átomos de cada elemento a ambos lados de la flecha. Se dice entonces que la ecuación está balanceada.
Lecciones orales:
Cada equipo deberá investigar sobre lo que se solicite.
¿Cómo presentar la investigación?
· Armar un trabajo con carátula, índice, desarrollo, Detalle del juego, mapa mental y bibliografía.
· Grabar un vídeo de máximo 10 minutos con la lección oral de cada miembro del equipo. Deberá estar compaginado para pasarlo en el zoom. (Todos deberán estar atentos a defenderlo ante cualquier consulta)
· Armar un mapa mental resumen para que cada compañero tenga en su carpeta. Lo presentarán en el zoom al terminar.
· Pensar un juego en formato virtual como cierre: rosco, preguntados, etc. (investigar páginas, kahoot!, juego de la oca y otros, la profesora los habilitará a compartir la pantalla y que todos los alumnos que los escucharon puedan participar).
Atención: 1 semana antes de la fecha de presentación del oral, deberán enviar el trabajo completo que incluye explicación del juego y mapa mental. También el vídeo. (el referente de equipo que uds elijan)
Equipo 1:
Alumnos: Alier, Miño, Estevez, Pedroni y Pombo
Tema: Hidratos de carbono
¿Qué son?
¿Cuál es su estructura?
Funciones
¿Qué alimentos tienen hidratos de carbono?
¿Qué importancia tiene en una dieta?
¿Qué sucede con el exceso de consumo o con su falta de consumo?
¿Qué es la celiaquía?
Fecha de exposición x zoom: 16/9
Equipo 2:
Alumnos: Álvarez, Vazquez, Luca, Zayas.
Tema: Lípidos
¿Qué son?
¿Cuál es su estructura?
Funciones
¿Qué tipo de lípidos hay?
¿Qué alimentos contienen lípidos o grasas?
¿Qué importancia tiene en una dieta?
¿Qué sucede con el exceso de consumo o con su falta de consumo?
¿Por qué se relacionan con los triglicéridos?
Fecha de exposición x zoom: 23/9
Equipo 3:
Alumnos: Cáceres, Peñarol, Aguirre, Molina y Scotto.
Tema: Proteínas
¿Qué son?
¿Por qué son importante los aminoácidos para las proteínas?
¿Cuál son sus estructuras?
Funciones
¿Qué alimentos tienen Proteínas?
¿Qué importancia tiene en una dieta?
¿Qué sucede con el exceso de consumo o con su falta de consumo?
Fecha de exposición x zoom: 30/9
Equipo 4:
Alumnos: Gonzalez, Vargas,Patiño y Ricci.
Tema: Frutas y verduras
¿Qué importancia tiene en una dieta?
¿Se pueden clasificar por color o por temporada? Explica
¿Qué son las vitaminas y cuáles hay?
¿Qué son los minerales y cuáles hay?
Ventajas y desventajas de consumir frutas y verduras. ¿Qué sucede con el exceso de consumo o con su falta de consumo?
Fecha de exposición x zoom: 7/10
Equipo 5:
Alumnos: López Ezequiel, Dominguez, Ramirez y Suarez.
Tema: Tipos de conservas.
¿Qué son? Y ¿Para qué realizarlas?
Explica detalladamente cada uno de los tipos de conservas con ejemplos.
¿Qué importancia tiene en una dieta?
¿Existe alguna enfermedad que se pueda adquirir por su consumo?
Fecha de exposición x zoom: 14/10
Equipo 6:
Alumnos: Avdeichuk, Knaus, Lezcano y Mollo.
Tema. Aditivos y conservantes
¿Qué son?
¿Son seguros? ¿Cómo determino su seguridad?
¿Cómo se metaboliza por el organismo?
¿Qué son los números E?
¿Qué importancia tiene en una dieta?
¿Pueden ocasionar alguna enfermedad su exceso o déficit?
Fecha de exposición x zoom: 21/10
8 de Setiembre
2do año
Copiar en la
Carpeta
El
origen de la electricidad
La energía eléctrica o
electricidad es un fenómeno físico que se produce a raíz de las
cargas eléctricas y de la interacción entre ellas. De esta forma, son los
electrones y los protones las principales partículas subatómicas responsables
de su aparición.
La electricidad se puede
originar o transmitir provocando el movimiento de cargas eléctricas de un punto
a otro. Se trata de una situación muy común dentro de la propia naturaleza,
donde la energía eléctrica se manifiesta de diversas formas, transformándose en
otros tipos de energía.
Ejemplos de este fenómeno son las tormentas eléctricas o el sistema nervioso de
los seres vivos.
Las cargas
eléctricas se pueden mover a través de los materiales, pero no lo hacen de la
misma manera en todos ellos. A la propiedad que indica la facilidad con que las
cargas se mueven a través de un material específico se la
denomina conductividad.
Según su
conductividad, podemos dividir todos los materiales en dos grandes grupos:
Materiales
conductores. Son
los que tienen una estructura atómica que favorece que las cargas eléctricas se
puedan mover con facilidad por su interior. En general, todos los metales son
buenos conductores.
Materiales
aislantes. Son
los que tienen los electrones muy ligados al átomo al que pertenecen, de manera
que no se pueden mover con facilidad. Algunos ejemplos aislantes son la madera,
la resina o el cristal.
Cuando los
electrones se mueven a través de un material conductor se origina lo que se
denomina corriente eléctrica. Se trata de un movimiento de cargas
eléctricas que se puede comparar, por ejemplo, con el que hace el agua de un
río: de la misma manera que ponemos medir el caudal de un río en un punto
concreto, podemos medir la intensidad de la corriente eléctrica.
Para que el
movimiento de electrones se produzca es necesario que entre los extremos del
conductor haya una diferencia de potencial a la que se
denomina tensión o voltaje.
En un generador, el
movimiento de electrones (de carga negativa) se produce desde su polo positivo
hasta su polo negativo. Si, por el contrario, este flujo es al revés (de polo
negativo a positivo), se considera que la corriente es negativa. De esta forma,
el sentido del movimiento de los electrones determina la
siguiente clasificación de corriente eléctrica:
Corriente
continua. Se caracteriza
porque los electrones se mueven en un solo sentido por el hilo conductor.
Ejemplos de generadores de corriente continua son las pilas o las dinamos.
Corriente
alterna. Su
característica principal es que los polos del generador cambian de negativo a
positivo en el mismo periodo, provocando que el flujo de electrones no mantenga
el mismo sentido. La generación de este tipo de corriente la realizan los
alternadores.
Entonces: Cuando los electrones se mueven, estos cargan
energía eléctrica de un lugar a otro. Este fenómeno es conocido como electricidad corriente o corriente eléctrica. Este tipo de energía está
relacionada con el funcionamiento de los aparatos eléctricos que usamos a
diario, como las lavadoras, los teléfonos, las lámparas, etc.
Para que una corriente de electricidad ocurra, debe
haber un circuito. Un circuito es un recorrido cerrado o bucle alrededor del
cual una corriente eléctrica fluye. Un circuito usualmente está hecho de
componentes eléctricos que se encuentran conectados a través de piezas de
cable. Así, en una lámpara portátil, hay un circuito simple con un interruptor,
una lámpara y una batería conectadas a través de algunas piezas de cable de
cobre. Cuando activas el interruptor, la electricidad fluye alrededor del
circuito. Si hay un corte en alguna parte del circuito, la electricidad no
puede fluir.
Pero no siempre se necesitan cables para hacer un
circuito. Existen circuitos formados por nubes de tormentas y la tierra y el aire
entre estas. Normalmente el aire no conduce electricidad, sin embargo, si hay
una carga eléctrica lo suficientemente grande en las nubes, se pueden crear
partículas cargadas en el aire, llamadas iones. Los iones trabajan como un
cable invisible que une las nubes de arriba y el aire de abajo y los rayos
fluyen a través del aire entre los iones.
Antes de la invención de la electricidad, la gente
tenía que hacer energía para cualquier cosa que quisieran hacer. Por lo tanto,
tenían que tener madera o velas para iluminar o calentar sus casas. La
invención de la electricidad cambió todo eso, ya que la electricidad se podía
hacer en un lugar y abastecer los sitios donde se necesitará, incluso a grandes
distancias. La gente ya no se tenía que preocupar de crear su propia energía
para calentar e iluminar sus casas, solo tenían que enchufar o activar el
interruptor y la energía se encontraba ahí disponible.
Actividad: Averigua ¿En la historia se relacionó la
electricidad y el magnetismo? Tenelo en la carpeta, lo conversaremos en el
zoom.
___________________________________________________________________________
3er
año
Copiar en la
Carpeta
Las sales
terciarias son compuestos iónicos de tres elementos y derivan de la sustitución
de un hidrógeno por otro catión en los ácidos ternarios. Ordinariamente, los
elementos de estas sales son: un metal, un no metal y oxígeno. Entonces, pueden
considerarse como “sales oxigenadas”.
![]() HIDRÓXIDO +
OXOÁCIDO SAL + H2O
HIDRÓXIDO +
OXOÁCIDO SAL + H2O
![]() X (OH)-
+ H X O X
(XO)- + H2O
X (OH)-
+ H X O X
(XO)- + H2O
Según el ejemplo que hicimos juntos
en el zoom se deben seguir los siguientes pasos:
1- Neutralizar las
cargas del hidróxido y del oxoácido
2- Neutralizar la
sal, recordar que el (XO) tiene una carga negativa
3- Balancear 1ero el
no metal, luego el metal y finalmente el agua
ACTIVIDAD: Tratar de
resolver los siguientes ejercicios que corregiremos en el zoom:
1) Hidróxido Niobica
+ Ácido hipofosforoso
2) Hidróxido de cinc
+ Ácido carbónico
3) Hidróxido de
Tecnecio (7) + ácido Arsenioso
4to
año
Copiar en la
Carpeta
Calor y temperatura: no son lo mismo
Se acercan, o ya están aquí, los meses
cálidos del año, y coloquialmente hablamos de calor y de temperaturas de forma
casi similar. Pero estos términos no son lo mismo.
A veces hemos oído en los meses cálidos
de primavera y verano: “sube el calor, el calor aprieta, se espera una semana
de fuerte calor, “y así sucesivamente. Se emplea el calor como sinónimo de
temperatura altas o ´persistentemente altas. Estos dos términos llevan vidas paralelas,
pero nunca se “cruzan”.
El calor es una forma de energía y se mide en el Sistema Internacional de Unidades en Julio, aunque también se usa con
frecuencia la caloría o kilocaloría. La temperatura es una unidad intrínseca del
estado térmico de una sustancia,
independiente de su tamaño, y se mide en ºC, ºF, ºK, etc...
Cuando el sol calienta la tierra, ésta
calienta el aire y su temperatura aumenta. Cuando la superficie de la tierra se
enfría, baja la temperatura. Por eso se oye hace
calor o hace frío, o se dice ¡qué calor hace o qué frío! sinónimo de
temperaturas altas o frías según el caso. Sin embargo, calor y temperatura son
conceptos diferentes y no sinónimos en términos absolutos.
El calor se puede asimilar a la energía
total del movimiento molecular en una sustancia, mientras temperatura es una
medida de la energía molecular media. El
calor depende de la velocidad de las partículas, su número, su tamaño y su tipo. La temperatura no depende del tamaño, ni del número o del tipo. Las
temperaturas más altas tienen lugar cuando las moléculas se están moviendo,
vibrando y rotando con mayor energía.
Temperatura y calor no son términos
equivalentes en meteorología ni se deben intercambiar alegremente en el
lenguaje coloquial. Cada uno tiene un lugar y un sitio claro en el mundo de los
términos meteorológicos.
De ésta gran diferenciación vamos a tomar el calor para poder meternos en un gran tema que es la termodinámica. Ésta última es la parte de la física que se encarga de la relación entre el calor y el trabajo.
Trabajo y calor son métodos de transferencia
de energía. Utilizan la misma unidad de medida en el Sistema Internacional, el
julio ( J ). Además, es habitual utilizar la caloría (cal)
para medir el calor. La conversión entre calorías y julios viene dada por:
1 cal = 4.184 J ⇔ 1 J = 0.24 cal
Esta relación puede verse mucho en el consumo de
los alimentos. En el estudio de las etiquetas.
Actividad: Busca una etiqueta
de fideos o arroz para hacer una actividad en el zoom próximo.
________________________________________________________________________
5to
año
Copiar en la
Carpeta
La fermentación implica
utilizar microorganismos para transformar la materia
orgánica, catalizadas por enzimas. Un alimento se considera
fermentado cuando uno o más de sus componentes químicos son atacados por
microorganismos, considerados útiles, por lo que su composición química resulta
modificada.
EL PROCESO DE LA FERMENTACIÓN
La fermentación se
puede definir como la transformación que sufren
ciertas materias orgánicas bajo
la acción de enzimas segregadas por microorganismos. Se trata
pues de un proceso de naturaleza bioquímica. La fermentación tiene lugar
en ambiente anaeróbico, con degradación de la sustancia orgánica en compuestos
intermedios que actúan de donadores y aceptores de electrones (proceso de
óxido-reducción) con liberación de energía.
Los sustratos de
las fermentaciones se incuban en bandejas, tanques o en recintos de temperatura
y humedad relativa controladas. Los sustratos líquidos se incuban en tanques de
acero inoxidable o en fermentadores cilíndricos agitados.
APLICACIÓN DE LA FERMENTACIÓN EN INDUSTRIAS ALIMENTARIAS:
Productos derivados de la fermentación alcohólica. Los
sustratos a partir de los cuales se produce la fermentación son en todos los
casos hidratos de carbono, pero difieren de unos productos a otros como también
son distintas las levaduras que realizan la fermentación y los requisitos que
se les exigen. Existen:
Vinos y sidras. En la obtención de vinos y sidras
el sustrato de la fermentación alcohólica son glucosa y fructosa. De forma
tradicional, la transformación de los mostos se ha desarrollado como un
fenómeno espontáneo, por medio de levaduras indígenas.
Cervezas. En el caso de la cerveza, las materias primas además del lúpulo y agua, son malta y otros cereales, por lo tanto, en este caso el sustrato lo constituyen la maltosa y la maltotriosa.
Bebidas destiladas. Las bebidas destiladas
aparecieron con el alambique. El fundamento de su proceso de elaboración es la
diferente riqueza en sustancias volátiles entre las fases líquida y vapor de un
producto calentado, lo que permite recoger el alcohol y los compuestos
aromáticos de los productos vegetales fermentados.
Productos de panadería. Las fermentaciones
tradicionales del pan se llevaban a cabo por los microorganismos presentes en
la harina, este sistema fermentativo está compuesto por levaduras y un complejo
de bacterias, principalmente lácticas.
Actividad: Investiga desde cuando apareció este
proceso y como fue poniéndose en práctica en la historia. Tenerlo en la carpeta
y lo conversamos en el zoom.
Hola a todos, espero que estén bien. Estamos cerrando el 2do
trimestre en todos los cursos y me parece que es bueno como siempre hacer una
actividad de metacognición, ósea significa, poner en una actividad todo el
conocimiento hasta ahora relacionado de alguna manera tal como lo han hecho de
la primera parte del año con un mapa mental.
Ahora la propuesta es la siguiente:
Individualmente van a escribir una carta, a quién Uds.
quieran, donde le van a contar:
·
Que temas aprendieron en físico química
·
Para qué creen que lo pueden usar en la vida
cotidiana
·
Que piensan de cómo llevo adelante la profesora
la explicación a pesar de la pandemia
·
Qué desearían que mejore la profesora para seguir
aprendiendo, si es que le quedan dudas.
En los encuentros de zoom charlaremos sobre esto, llamaré
por lista. Nos vemos!
__________________________________________________________________________________
2do Año: Copiar en la carpeta
Trabajo Práctico de uniones químicas: Ubica los
elementos en la tabla periódica, realiza la estructura de Lewis y sus fórmulas
correspondientes mínima, molecular y desarrollada según corresponda.
1)
Tantalio + Yodo
2)
Cadmio + carbono
3)
Indio + Telurio
4)
Cinc + Bromo
5)
Lantano + Azufre
6)
Selenio +Cloro
7)
Nitrógeno + Fósforo
8)
Selenio + Telurio
9)
Silicio + Cloro
1 Arsénico
+ flúor
Enviar por mail antes del 1/9 a gisellabarua@hotmail.com
3er Año: Copiar en la Carpeta
Las sales neutras o binarias son las combinaciones de un
hidróxido (metal) y un hidrácido (no metal). Su fórmula es X X y siempre en el
producto se obtiene agua:
![]() X
(OH)- + H X X X + H2O
X
(OH)- + H X X X + H2O
En la clase por zoom hicimos un
ejercicio juntos. Para seguir practicando les dejo estos ejemplos para que pongan
en práctica los aprendizajes. Cualquier duda me lo comentan en el próximo
encuentro donde haremos la auto-corrección.
1) 1) Hidróxido
crómico + ácido clorhídrico
2) 2) Hidróxido
de Escandio + ácido sulfhídrico
3)
Hidróxido de circonio + ácido fluorhídrico
4to año: Copiar en la carpeta
Completa el siguiente crucigrama
_
_ _ E _ _ R _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ N E
_ _ _ _ _ _ _ _ _
_E _ _ _ _ _N _ _
_ _ _ _ _ _ _ _
_
_ _ R _ _ _ _ _ O _ _
_ _
_
_ _ G _ _ _ _ _ _ V _ _ _ _
_ _
_ I _ _ _ _ _ A _ _
_
_ A _ _ _ _ _ B _ _
_ _ _ _ _ _ _ _ _ _ _
S _ _ _ _ _ _ L _ _ _ _ _ _ _ _
_ _ _ E _ _ _ _
_ _
S
E: La luna las afecta debido a la
gravedad
N: Producto del uso de la energía no
renovable
E: Ubicación en la tierra donde
hay mayor calor
R: Necesita para descubrirse un
gran despliegue e inversión de dinero
G: Que nunca se acaba
I: Energía que resulta de los
restos orgánicos
A: la colocación de aerogeneradores
lo arruinan
S: Utiliza energía por fusión
nuclear
R: En ellos se forma represas
E: circulan en los conductores
para dar energía eléctrica
N: Una desventaja de la energía hidroeléctrica
O: es una energía que provoca la muerte
de aves
V: son elemental para provocar
energía para los aerogeneradores
A: Importante en la energía geotérmica
B: Alternativa para el uso del gas
natural que ayuda al cuidado del planeta
L: beneficio que provoca el uso de
la energía en invierno
E: es una energía que se relaciona
con la velocidad
S: Se
extrae de la energía de los restos fósiles
NO ENVIAR, Corregiremos en el zoom del jueves
5to año:
Atención el miércoles 2/9 es
el tour virtual de 10 a 11 hs
Necesito que recuerden
inscribirse al siguiente link:
https://www.uade.edu.ar/fpcUade/registro/create/10?c=3067
Necesito
para el miércoles que tenemos el zoom la lista de mails de todos ya que el link
de ingreso a al tour se los pasaré vía mail. Elijan un referente y que me lo
mande sin falta. GRACIAS
También les mandaré por mail el instructivo para bajarse
la aplicación o guía de uso.
ACTIVIDAD: leer ésta información y armar un folleto o placa
que permita concientizarse sobre la importancia de leer y comprender las etiquetas
de los alimentos:
La importancia de leer las etiquetas
En
general, son pocas las personas que leen las etiquetas cuando compran. Sin
embargo, este simple acto permite saber lo que estamos comiendo y distinguir
qué es saludable y qué no, parte fundamental del concepto de alimentación sana,
según afirma la doctora Carolina González, nutrióloga de Clínica Alemana.
De
hecho, en Chile existe una política nacional regulada por el Instituto de Salud
Pública (ISP) que establece que todo producto debe incluir la información
nutricional en la etiqueta.
Generalmente,
se trata de una tabla con las calorías, proteínas, grasas, hidratos de carbono
y sodio, entre otras cosas. Lo importante es tener un conocimiento básico para
preferir, en general, productos con menos aporte de grasa, sodio y azúcar, y
con más fibra, siempre tomando en cuenta las indicaciones del médico,
especialmente cuando existe una patología de base.
Contenido
calórico
La
cantidad de calorías de un alimento debe ser analizada según los requerimientos
diarios de cada persona. 'Es aconsejable fijarse en las calorías por porción y
de acuerdo a eso consumir la fracción adecuada', sostiene la nutrióloga.
En
personas sanas y población general, el requerimiento calórico diario promedio
es de 1.600 a 1.800 calorías en mujeres, y entre 2.000 y 2.400 en hombres.
La
doctora González cita el caso de algunas personas con obesidad y sobrepeso,
quienes están acostumbradas a mirar sólo los azúcares y las grasas, y si el
producto no contiene azúcar lo consumen sin leer cuántas calorías está
aportando. 'Las calorías no siempre están asociadas al azúcar porque va a
depender de cuánta grasa y proteínas contiene, ya que cada macronutriente tiene
calorías. Que no tenga azúcar no significa que no tenga calorías', explica.
Por
ejemplo, los azúcares tienen 4 calorías por gramo, las grasas 9 calorías por
gramo y las proteínas 4 calorías por gramo.
Proteínas
La
especialista explica que las proteínas en las etiquetas son entregadas por
gramo. En este caso es muy importante que sean revisadas por las personas con
patologías renales, pacientes con restricción proteica y/o por quienes
necesitan una alimentación hiperproteica.
Hidratos
de carbono
Quienes
deben estar más alerta al consumo de hidratos de carbono son los pacientes
diabéticos, especialmente los tipos 1, ya que es fundamental que aprendan a
contar los carbohidratos que consumen porque de acuerdo a eso se calcula la
dosis de insulina que requieren.
'Esto
les permite tener un manejo más amplio de su alimentación midiendo,
exactamente, lo que comen para conseguir así una dieta amplia y balanceada',
sostiene la doctora González.
Grasas
La
mayoría de las personas tiene el concepto de grasas saludables y dañinas. Las
más perjudiciales son las saturadas (animales), ya que se relacionan con el
riesgo cardiovascular.
También
están las monoinsaturadas y polinsaturadas, consideradas beneficiosas desde el
punto de vista cardiovascular.
Respecto
del colesterol, la medida recomendada en la población general es menos de 300
miligramos para una dieta saludable, aunque las personas con el colesterol alto
deben consumir todavía menos, de acuerdo a la indicación de su médico.
En
dietas saludables, la grasa total debería ser menos de un 30% de las calorías
totales como grasa. Como concepto general, lo ideal es que el producto tenga
menos grasas saturadas, menos colesterol y más grasas mono y poliinsaturadas,
pero es importante entender que aunque son más sanas en cómo actúan
nutricionalmente, engordan lo mismo.
Grasas
trans
Las
grasas pueden tener distinta conformación bioquímica. Las trans se comportan
como grasas saturadas, siendo dañinas para el organismo. Es por esto que
actualmente la industria trabaja productos libres de este tipo de grasas, lo
que no quiere decir que sea libre de grasa y colesterol.
Fibra
Este
componente es sumamente importante en la dieta de todas las personas y se
considera recomendable consumir al menos 25 gramos al día para una buena
función intestinal y disminuir el riesgo de cáncer de colon. Incluso, se asocia
al mejor control de la diabetes, entre otros beneficios.
Vitaminas
y minerales
En
las etiquetas, las vitaminas y minerales están expresados como porcentaje de la
recomendación diaria en personas normales basado en el mínimo aconsejado para
no tener déficit de estos nutrientes.
Frente
a alguna alteración, es imprescindible la indicación del médico, por ejemplo,
la necesidad de ácido fólico al comienzo del embarazo, entre otras cosas.
Recomendaciones
La
doctora González afirma que hay personas que deben estar más atentas a lo que
compran:
Quienes
tienen indicada una dieta específica sin gluten, es vital que revisen la
etiqueta.
Las
personas alérgicas, por ejemplo, al maní, nueces y almendras, deben fijarse que
el producto no contenga frutos secos ni trazas de ellos.
Los
que no puedan consumir fenilalanina, deben mirar que el producto no contenga
aspartame.
Cuidado
con los productos con lactosa a quienes son intolerantes a ella.
Los
niños deben consumir de manera controlada el aspartame. Es mejor darle menos
azúcar. Un niño sólo debe consumir algunos productos con nutrasweet, por lo que
es mejor elegir productos endulzados con sucralosa.
Las
embarazadas deben tener una dieta variada y balanceada, evitando pescados
crudos y quesos maduros. Por ley todos los productos deben estar etiquetados
correctamente e indicar la composición de los mismos, así como su aporte
nutricional. Este etiquetado que para muchos no es útil, es una buena
herramienta a la hora de alimentarnos de manera correcta. Por ello vamos a
destacar los beneficios de dedicarle unos segundos a la lectura de las
etiquetas a la hora de adquirir cualquier alimento en el supermercado.
Evitar
llevarnos sustos en caso de alergia
En
primer lugar, esta lectura nos evitarás sustos en casos de alergias o
intolerancia a determinados alimentos, ya que muchas veces damos por hecho que
un alimento está libre
de
otro, pero contiene trazas. En casos como los celiacos los alimentos deben no
contener gluten ni estar infectados por él. Por ello la etiqueta será una
perfecta guía para controlar al máximo esto o en los casos de intolerancia a la
lactosa, ya que otros muchos contienen leche o derivados en su elaboración.
Conocer
los ingredientes a fondo
En
lo que a ingredientes se refiere, las etiquetas nos darán una pista de si ese
alimento que queremos adquirir está muy elaborado o en qué grado es más natural
o no. Por ello debemos tener presentes las cantidades de conservantes,
colorantes, aromas… que se utilizan en su elaboración. No es recomendable echar
mano habitualmente de alimentos muy procesados, pues a la larga nuestro cuerpo
puede pasarnos factura.
Las
tablas nutrionales
Lo
mismo sucede con las tablas nutricionales que nos ofrece el etiquetado, ya que
éstas nos servirán sobre todo para controlar las calorías y los aportes de
grasas y azúcares que nos llevamos a la boca. Muchas veces nos confundimos con
los alimentos, pues creemos que bajo en grasas quiere también decir sin azúcar,
cuando no es así, o lo mismo sucede a la inversa, ya que se pueden utilizar
edulcorantes, pero el alimento conservar el mismo aporte graso.
Tener
en cuenta las tablas nutricionales y usarlas como una guía a la hora de comprar
alimentos es una buena idea, pues será un buen indicador para conseguir
nuestros objetivos. No hay que olvidar que al final ahí está la información
importante y no en el embalaje, ya que siempre se usan colores y formas
atractivas que pesan más que lo que realmente contienen. Por ello es importante
tener siempre en cuenta las etiquetas de los productos y no dejarnos guiar por
las simples apariencias.
Leer
las etiquetas nos permite conocer la fecha de elaboración y vencimiento del
producto, y podemos identificar los ingredientes y aditivos que contiene. Hay
que tener en cuenta que la lista de ingredientes está ordenada de mayor a menor
según la cantidad presente en el alimento, es decir que los primeros
ingredientes en la lista son los más abundantes. Esto no es un dato menor,
podemos sorprendernos, por ejemplo, al ver productos como el cacao en polvo
donde su primer ingrediente es el azúcar.
Al
final de la lista tienen que estar los aditivos, estas son sustancias naturales
o artificiales que la industria agrega a los alimentos sin el propósito de
nutrir, sino con el objeto de modificar sus características. En este grupo
están los conservantes, saborizantes, colorantes, etc.
La
información nutricional indica las calorías del producto y su contenido de
nutrientes. Y todo esto debe estar expresado por porción, incluyendo la medida
casera correspondiente. Hay que tener presente que el tamaño de la porción es
un valor general y no necesariamente se ajusta a los requerimientos
individuales de cada persona. ¡Respetar el tamaño de la porción es fundamental
en una alimentación saludable!
Cuando
compramos un alimento “Light” no siempre estamos comprando algo con bajas
calorías. La palabra light significa bajo, leve, liviano, reducido. Para que un
alimento sea considerado “Light” el mismo debe presentar una reducción del 25%
en algún nutriente (azúcar, grasa, sal, etc...) con respecto al producto
original.
Al
leer los ingredientes y la información nutricional podemos comparar entre
productos, y de esta manera elegir alimentos que tengan menos cantidad de
colesterol, grasas saturadas y trans, sodio, azucares, y aquellos que tengan
más fibra, grasas poli y monoinsaturadas, vitaminas y minerales.
Por
lo tanto, saber qué contienen los alimentos envasados es un derecho que tenemos
todos los consumidores, pero es nuestra responsabilidad hacernos el h
El miércoles 2/9 en el zoom compartirán pantalla y mostrarán la propuesta realizada. En el caso de no saber compartir la pantalla lo mandan por mail y se los pongo yo en la pantalla. ¡¡Deberán explicarlo!!
Actividad:
1) 1) Fósforo + Cloro
2) 2) Carbono + Azufre
3) Realizaremos auto-corrección en el zoom de ésta semana.
_________________________________________________________________________
5 3er año. Copiar en la carpeta
Hidrácidos:
Los hidrácidos, también conocidos como ácidos hidrácidos o hidruros , son compuestos químicos que surgen por combinación de átomos de hidrógeno con átomos de halógenos (flúor, cloro, bromo o yodo), o bien con el átomo de azufre.
Los primeros actúan con estado de oxidación -1 y el azufre con estado de oxidación -2, por lo que en el caso de los hidrácidos la fórmula que los representa es:
H X
Copiar el cuadro siguiente:
Observen varias veces el cuadro y las 2 nomenclaturas.
Trabajo de investigación:
Lee las consignas y luego responde con un buen desarrollo
teórico adjuntando dibujos.
1)
¿En qué se diferencia la energía renovable de la
energía no renovable?
2)
¿Por qué el Petróleo es tan utilizado? Explica
la energía de los restos fósiles.
3)
Investiga sobre las siguientes energías
renovables y arma una infografía de cada una:
·
Hidráulica
·
Solar
·
Eólica
·
Mareomotriz
·
Geotérmica
Enviar por mail antes del 25/8. gisellabarua@hotmail.com
En el zoom de ésta semana me pueden preguntar las dudas que
se les presenten.
_________________________________________________________________________
5to año. Copiar en la carpeta y comenzar a organizarse! Agendar
Lecciones orales:
Cada equipo deberá investigar sobre lo que se solicite.
¿Cómo presentar la investigación?
·
Armar un trabajo con carátula, índice,
desarrollo, Detalle del juego, mapa mental y bibliografía.
·
Grabar un vídeo de máximo 10 minutos con la
lección oral de cada miembro del equipo. Deberá estar compaginado para pasarlo
en el zoom. (Todos deberán estar atentos a defenderlo ante cualquier consulta)
·
Armar un mapa mental resumen para que cada
compañero tenga en su carpeta. Lo presentarán en el zoom al terminar.
·
Pensar un juego en formato virtual como cierre:
rosco, preguntados, etc. (investigar páginas, kahoot!, juego de la oca y otros,
la profesora los habilitará a compartir la pantalla y que todos los alumnos que
los escucharon puedan participar).
Atención: 1
semana antes de la fecha de presentación del oral, deberán enviar el trabajo
completo que incluye explicación del juego y mapa mental. También el vídeo. (el referente de equipo que uds elijan)
Equipo 1:
Alumnos:
Alier, Miño, Estevez, Pedroni y Pombo
Tema:
Hidratos de carbono
¿Qué
son?
¿Cuál
es su estructura?
Funciones
¿Qué
alimentos tienen hidratos de carbono?
¿Qué
importancia tiene en una dieta?
¿Qué
sucede con el exceso de consumo o con su falta de consumo?
¿Qué
es la celiaquía?
Fecha de exposición x zoom: 16/9
Equipo 2:
Alumnos:
Álvarez, Vazquez, Luca, Zayas.
Tema:
Lípidos
¿Qué
son?
¿Cuál
es su estructura?
Funciones
¿Qué
tipo de lípidos hay?
¿Qué
alimentos contienen lípidos o grasas?
¿Qué
importancia tiene en una dieta?
¿Qué
sucede con el exceso de consumo o con su falta de consumo?
¿Por qué
se relacionan con los triglicéridos?
Fecha de exposición x zoom: 23/9
Equipo 3:
Alumnos:
Cáceres, Peñarol, Aguirre, Molina y Scotto.
Tema:
Proteínas
¿Qué
son?
¿Por
qué son importante los aminoácidos para las proteínas?
¿Cuál
son sus estructuras?
Funciones
¿Qué
alimentos tienen Proteínas?
¿Qué
importancia tiene en una dieta?
¿Qué
sucede con el exceso de consumo o con su falta de consumo?
Fecha de exposición x zoom: 30/9
Equipo 4:
Alumnos:
Gonzalez, Vargas,Patiño y Ricci.
Tema:
Frutas y verduras
¿Qué
importancia tiene en una dieta?
¿Se
pueden clasificar por color o por temporada? Explica
¿Qué
son las vitaminas y cuáles hay?
¿Qué
son los minerales y cuáles hay?
Ventajas
y desventajas de consumir frutas y verduras. ¿Qué sucede con el exceso de
consumo o con su falta de consumo?
Fecha de exposición x zoom: 7/10
Equipo 5:
Alumnos:
López Ezequiel, Dominguez, Ramirez y Suarez.
Tema:
Tipos de conservas.
¿Qué
son? Y ¿Para qué realizarlas?
Explica
detalladamente cada uno de los tipos de conservas con ejemplos.
¿Qué
importancia tiene en una dieta?
¿Existe
alguna enfermedad que se pueda adquirir por su consumo?
Fecha de exposición x zoom: 14/10
Equipo 6:
Alumnos: Avdeichuk,
Knaus, Lezcano y Mollo.
Tema.
Aditivos y conservantes
¿Qué
son?
¿Son
seguros? ¿Cómo determino su seguridad?
¿Cómo
se metaboliza por el organismo?
¿Qué
son los números E?
¿Qué
importancia tiene en una dieta?
¿Pueden
ocasionar alguna enfermedad su exceso o déficit?
Fecha de exposición x zoom: 21/10
Nos
encontramos en el zoom de ésta semana.
__________________________________________________________________________________________
Adjunto las auto-correcciones que trabajamos 2do, 3ero y 4to:
11 DE AGOSTO
2DO AÑO
Copiar en la carpeta
UNIONES QUÍMICAS: Explicación
En la naturaleza los átomos de la tabla periódica, se combinan obteniendo moléculas como la molécula de H2O o el vídeo de iones. Cuando un átomo neutro, participa de una unión química, si cede electrones se convierte en catión (carga +) pero sin toma electrones se convierte en un anión (carga -)
Ej: Cloro y sodio. Son átomos neutros que
están en la tabla periódica pero si se unen entre ellos pasa lo siguiente:
Na (tiene un electrón para ceder en el último
nivel de energía)
Cl (Tiene 7 electrones en el último nivel de energía y para ser estable debe tomar un electrón y así cumplir la ley del octeto, que habla de que si logra un átomo al unirse tener 8 electrones en su último nivel se dice que se convierte en un átomo estable y que se parece a los gases inertes)
Entonces al unirse forman la sal: Cloruro de socio: Na Cl
Donde el sodio es un catión de carga
positiva porque fue el que cedió 1 electrón y el cloro un anión de carga
negativa porque tomó 1 electrón para lograr la estabilidad. Finalmente ésta
unión da origen a la sal de mesa. SORPRENDENTE!!!! No?
Como las uniones químicas suceden y no
es posible observarlo a partir de los ojos, el científico LEWIS explicó los
diagramas para demostrar lo que sucede en dichas uniones.
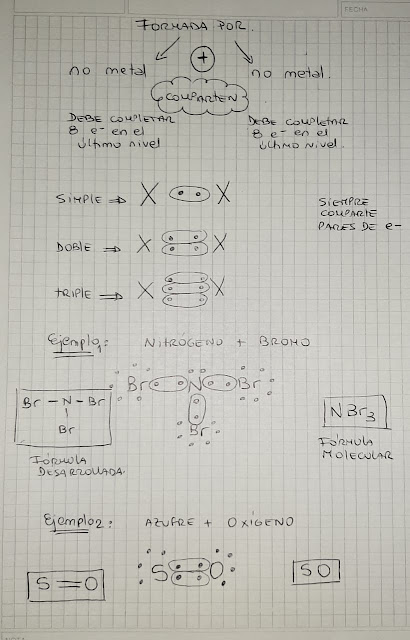
Existen 2 tipos de uniones químicas:
· Uniones iónicas que suceden entre un elemento metal y otro
elemento no metal donde el metal cede el electrón y el no metal toma electrones
buscando la estabilidad o ley del octeto.
· Uniones covalentes que suceden entre un elemento no metal y otro
elemento no metal COMPARTIENDO electrones y ambos lograr la estabilidad o ley
del octeto.
En primera instancia vamos a aprender
las uniones químicas iónicas. Los invito a ver el siguiente vídeo prestando
atención prioritariamente a las uniones iónicas, más adelante los haré mirar el
mismo vídeo nuevamente para retomar las uniones covalentes.
Ver vídeo por éste link:
https://drive.google.com/file/d/1TVmVm7SkFNbE5AHRsN49ZvkCdyu1lGd-/view?usp=sharing
Uniones iónicas:
Copiar lo que se muestra en la foto,
es como un resumen!
Ver 2 vídeos de tutorial que explican
el resumen.
Actividad: trata luego de mirar los tutoriales de hacer
las siguientes uniones iónicas:
1) 1) Litio + Nitrógeno
2) 2) Aluminio + Oxígeno
3) 3) Carbono + Oxígeno
R Realizaremos auto-corrección en el zoom de ésta semana. Llamaré por lista, todos lo deben intentar hacer.
_______________________________________________________________________3 ER AÑO
Copiar en la carpeta
ÁCIDOS: se dividen en Hidrácidos y
oxoácidos
Recuerden que la molécula de agua al dividirse
en H+ (llamado protón) y en OH- (llamado oxidrilo) da como resultado compuestos
diferentes. Cuando estudiamos Hidróxido utilizamos en la formación del producto
el oxidrilo, en cambio, ahora que estudiaremos ácidos vamos a utilizar el
PROTÓN.
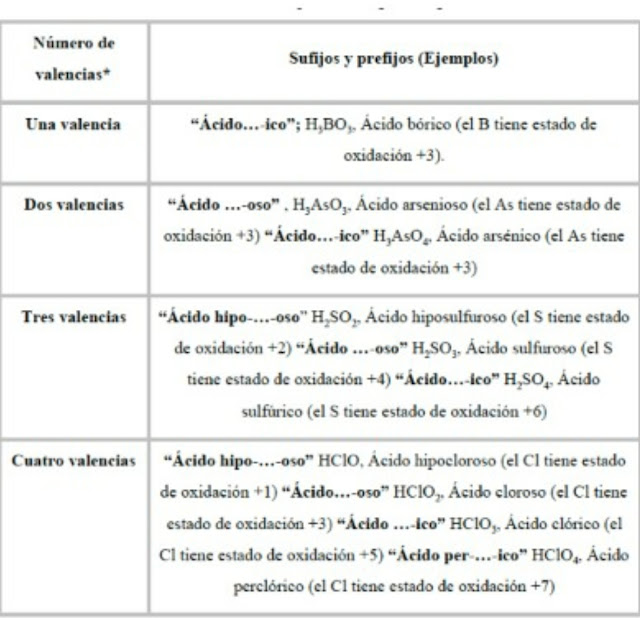
OXOÁCIDOS:
Los Oxoácidos son compuestos triatómicos
(tres átomos) integrados por el oxígeno, un elemento no metal y el hidrógeno.
La fórmula general de los oxoácidos es:
H (a) X (b) O (c)
Donde el hidrógeno (a) actúa con estado de oxidación
+1 hace referencia a la parte electropositiva del compuesto, mientras
que el oxígeno (b), que actúa con estado de oxidación -2, y
el elemento no metal (c) que actúa con carga positiva.
Nomenclatura tradicional: se
nombra con la palabra ácido seguido de la raíz del elemento no
metálico e indicando la valencia con la que actúa según el siguiente criterio.
Ver vídeo de guía
https://drive.google.com/file/d/1rqpPEQy-08wa7tdxc5Eg6-ZF28BibemI/view?usp=sharing
Tener en cuenta que siempre para formar un
ácido se debe armar un óxido ácido (no metal + oxígeno) y agregarle agua, de
esa manera se obtiene como producto H X O.
Copiar foto resumen
Ver tutorial
Actividad:
Realizar las ecuaciones de los correspondientes ácidos. Balancear
1) Ácido
Bromoso
2) Ácido
Carbónico
3) Ácido
Hipofosforoso
Realizaremos auto-corrección en el zoom de ésta semana. Llamaré por lista, todos lo deben intentar hacer.
______________________________________________________________________4 TO AÑO
Copiar en la carpeta
|
PRINCIPIO DE
CONSERVACIÓN DE LA ENERGÍA |
|
El Principio
de conservación de la energía indica que la energía no se crea ni se destruye; sólo se transforma de unas
formas en otras. En estas transformaciones, la energía total permanece
constante; es decir, la energía total es la misma antes y después de cada
transformación. |
|
En el caso de la energía mecánica se puede
concluir que, en ausencia de rozamientos y sin intervención de ningún trabajo
externo, la suma de las energías cinética y potencial permanece constante.
Este fenómeno se conoce con el nombre de Principio de conservación de la energía mecánica. Para poder concluir con la fórmula final de
energía mecánica debemos conocer: ¿Qué es la energía cinética? La que depende de la
velocidad La energía
cinética es aquella energía que posee un cuerpo o sistema debido a
su movimiento. La física la define como la cantidad
de trabajo realizado
por todas las fuerzas que actúan sobre un cuerpo con una masa determinada, necesario para
acelerarlo desde una velocidad inicial hasta otra velocidad final. Su fórmula es:
V= es la velocidad que siempre está en
m/s ¿Qué es la energía potencial? La que depende de la altura La energía
potencial es la energía que un objeto posee debido a su posición en un campo
de fuerzas. Esta forma de
energía se asocia con las fuerzas que actúan sobre un cuerpo de tal manera
que esto sólo depende de la posición del cuerpo en el espacio Su fórmula es: M= es la masa que
siempre tiene que estar en Kilogramo G= es la gravedad 9.8 m/s2 H= es la altura que siempre está en metros ¿Qué es la energía mecánica? La que depende de la
velocidad y la altura. Su fórmula es: ATENCIÓN: La magnitud
escalar de la energía cinética, potencial y mecánica es la unidad de medida
del Sistema Internacional de Unidades: joule (J). Actividad: Realizar los
siguientes ejercicios considerando las fórmulas presentadas: A) Calcular la energía potencial que
almacena una caja de 0,5 toneladas al ser elevada a una altura de 232000
milímetros. B) Calcular la energía cinética de la
caja del ejercicio anterior que obtuvo en cada etapa recorrida hasta alcanzar
los 232000 milímetros: 1) V= 150 m/s 2)
V= 180 m/s
3)
V= 120 m/s C) Calcular
la energía mecánica que realiza la caja en la velocidad de 180 m/s Realizaremos auto-corrección en el zoom de ésta semana. Llamaré por lista, todos lo deben intentar hacer. ___________________________________________________________________________________________________________ 5to AÑO Copiar en la carpeta Biomoléculas Las biomoléculas son sustancias imprescindibles que forman parte de los seres vivos, y que cumplen una serie de funciones importantes para su buen funcionamiento biológico. Las biomoléculas se forman a partir de los
seis elementos químicos más abundantes en los organismos, que son: el carbono
(C), el hidrógeno (H), el nitrógeno (N), el oxígeno (O), el fósforo (P) y el
azufre (S). De estos elementos se componen las biomoléculas
conocidas como aminoácidos, glúcidos, lípidos, proteínas, ácidos nucleicos y
vitaminas, las cuales son indispensables para la formación y funcionamiento de
las células que componen los tejidos y los órganos de los seres vivos. Es
decir, las biomoléculas son esenciales para la existencia de los seres vivos. Se caracterizan por
tener bases de carbono y por ser sintetizadas por los seres vivos a través de
diversas reacciones químicas del metabolismo. Estas biomoléculas se agrupan de
la siguiente manera: Aminoácidos: conforman la base de las proteínas y
participan en diversos procesos biológicos. Por ejemplo: glutamina, cisteína,
entre otras. Glúcidos
o hidratos de carbono: también
llamados carbohidratos, son una fuente de energía importante para los seres
vivos. Por ejemplo, glucosa, almidón, celulosa, entre otros. Lípidos: se encargan de diversas funciones, entre la
que destaca la reserva de energías para el cuerpo. Se dividen en dos grupos,
saponificables (ácidos grasos, fosfolípidos, entre otros) e insaponificables (esteroides). Proteínas: participan en gran cantidad de procesos
biológicos. Algunos ejemplos son: enzimas, hormonas, anticuerpos, entre otros. Ácidos
nucleicos: proporcionan
información biológica de vital importancia para el funcionamiento de los
organismos. Por ejemplo: ADN y ARN. Vitaminas: se encargan del funcionamiento fisiológico.
Algunos ejemplos son: vitamina A, vitamina C, complejo vitamínico B, entre
otros.
Las principales
funciones de las biomoléculas son: ·
Conforman
la materia empleada por las células que, posteriormente forman los tejidos,
órganos y demás estructuras necesarias para la existencia de seres vivos. ·
La
deficiencia de las biomoléculas genera problemas de salud y enfermedades. ·
Libera
energía a través de los glúcidos. ·
Permiten la
construcción de enlaces múltiples de elementos. ·
Transportan
nutrientes y otro tipo de sustancias. ·
Controlan
el correcto funcionamiento de los organismos vivos. ·
Contienen
información genética, gracias a los ácidos nucleicos, que será heredada por
cada organismo. Macronutrientes Serían
los nutrientes que nos aportan energía. Son fundamentales para el
organismo, en mayor cantidad que los micronutrientes. En este grupo se
incluirían grasas, carbohidratos, proteínas y agua. Dicha energía se mide en
calorías y es esencial para el correcto funcionamiento de los procesos de nuestro
cuerpo. Son las proteínas, hidratos de carbono, lípidos y agua. Micronutrientes Son imprescindibles para la correcta actividad diaria, pero la cantidad que requiere el cuerpo es menor que
la de los macronutrientes. La labor que desempeñan es mayoritariamente la de favorecer numerosas reacciones químicas internas.
En este grupo estarían las vitaminas y los minerales.
¿Es lo mismo alimentarse que nutrirse? Alimentarse es simplemente ingerir cualquier alimento,
ya sean alimentos sanos o alimentos que no aportan nada a nuestro
organismo. Lo podemos llamar comida basura o “chatarra alimentaria”. Nutrirse, sin
embargo, es ingerir alimentos que aportan a nuestro organismo los
nutrientes esenciales: vitaminas, minerales, fibras, proteínas… Nutrientes
que ayudan que nuestro cuerpo funcione mejor y a que tengamos más energía.
Proceso de digestión: Un alimento es realmente incorporado al
organismo después de ser digerido, es decir, degradado física y químicamente
para que sus componentes puedan ser absorbidos, es decir, pueda atravesar la
pared del aparato digestivo y pasar a la sangre (o a la linfa). Proceso de digestión Antes de que todos estos
componentes puedan ser utilizados o metabolizados, los alimentos deben sufrir
en el cuerpo diversos cambios físicos y químicos que reciben el nombre de
digestión y que los hacen "absorbibles", aunque no siempre es necesario
que se produzca algún cambio para que el componente se absorba. Por ejemplo, el
agua, los minerales y ciertos hidratos de carbono se absorben sin modificación
previa. En otros casos, el proceso culinario ya inicia cambios químicos en el
alimento antes de entrar en el cuerpo: el cocinado ablanda las fibras de carne
y la celulosa de los alimentos de origen vegetal y gelatiniza el almidón. Sin
embargo, el verdadero proceso de la digestión no comienza hasta que el alimento
está en el aparato digestivo. En el proceso de digestión también intervienen
las glándulas salivares, el hígado y el páncreas y está regulado por mecanismos
nerviosos y hormonales. La digestión consiste en dos procesos, uno mecánico y
otro químico. La parte mecánica de la digestión incluye la masticación,
deglución, la peristalsis y la defecación o eliminación de los alimentos. En la boca se produce la mezcla y humectación
del alimento con la saliva, mientras éste es triturado mecánicamente por
masticación, facilitando la deglución. La saliva contiene ptialina, una enzima
que hidroliza una pequeña parte del almidón a maltosa. De la boca, el alimento
pasa rápidamente al esófago y al estómago, donde se mezcla con los jugos
gástricos constituidos por pepsina (una enzima que comienza la digestión de las
proteínas), ácido clorhídrico y el factor intrínseco, necesario para que la
vitamina B12 se absorba posteriormente. El tiempo de permanencia del quimo
(mezcla semilíquida del alimento) (2-4 horas) depende de múltiples factores,
como por ejemplo, el tipo de alimento. Aquellos ricos en grasas permanecen más
tiempo y los que tienen grandes cantidades de hidratos de carbono pasan
rápidamente. En el
intestino delgado tiene lugar la mayor parte de los procesos de digestión y
absorción. El alimento se mezcla con la bilis, el jugo pancreático y los jugos
intestinales. Durante la fase química de la digestión diferentes enzimas rompen
las moléculas complejas en unidades más sencillas que ya pueden ser absorbidas
y utilizadas. Algunas de las enzimas más importantes son la lipasa (que rompe
las grasas en ácidos grasos), la amilasa (que hidroliza el almidón) y las
proteasas (tripsina y quimotripsina, que convierten las proteínas en
aminoácidos). En el
intestino grueso, las sustancias que no han sido digeridas pueden ser fermentadas
por las bacterias presentes en él, dando lugar a la producción de gases.
Igualmente pueden sintetizar vitaminas del grupo B y vitamina K, aportando
cantidades adicionales de estas vitaminas que serán absorbidas.
Proceso de absorción de nutrientes El proceso de absorción de
nutrientes se produce principalmente y con una extraordinaria eficacia a través
de las paredes del intestino delgado, donde se absorben: las macronutrientes. En el intestino grueso,
donde se reabsorbe una importante cantidad de agua, micronutrientes y del residuo que llega del
intestino delgado, se almacenan las heces hasta ser excretadas por el ano. Las
heces, además de los componentes no digeridos de los alimentos, contienen gran
cantidad de restos celulares, consecuencia de la continua regeneración de la
pared celular. Una vez absorbidos los nutrientes son transportados por la
sangre hasta las células en las que van a ser utilizados.
Las vitaminas pueden
absorberse en menor cantidad si se ingieren sustancias que aceleran la
velocidad de tránsito intestinal, como la fibra ingerida en grandes
cantidades y los laxantes. ACTIVIDAD: Investiga sobre: 1) A qué se denomina metabolismo basal y del ejercicio? 2) Cual es la función del consumo de fibra? 3) Por qué es importante el consumo de agua? Enviar por mail antes del 17/8. ____________________________________________________________________________ |
aquí:
https://www.uade.edu.ar/fpcUade/registro/create/10?c=3067
El tour se realizá mediante la plataforma Teams. Enviarán el link unos días antes.
Atención separamos en grupos para hacer una presentación de biomoléculas oral. El martes que viene pasaré las consignas y fechas de entrega. Recuerdo grupos para que puedan irse comunicando:
Alier, Miño, Estevez, Pedroni y Pombo tema: Hidratos de carbono
Álvarez, Vazquez, Luca, Zayas. Tema: Lipidos
Cacerers, Peñarol, Aguirre, Molina y Scotto. Tema: Proteínas
Gonzalez, Vargas,Patiño y Ricci. Tema: Frutas y verduras
López Ezequiel, Dominguez, Ramirez y Suarez. Tema: Tipos de conservas.
Avdeichuk, Knaus, Lezcano y Mollo. Tema. Aditivos
________________________________________________________________
Buenos días estamos cerrando la 1era etapa del año, nos sorprendió una situación inédita que nos llevó a adaptarnos a una nueva forma de aprendizaje a distancia. Al principio costó mucho la adaptación, pero juntos y con la ayuda de nuestro señor salimos adelante. Quiero agradecerles el compromiso puesto es ésta nueva propuesta, el escollo fue grande pero juntos lo pudimos pasar. Estuve viendo las producciones de los mapas mentales y están geniales....a la vuelta de las vacaciones comenzaremos desde éste cierre de contenidos que cada uno de uds armó y aún está armando. Llego el momento de cerrar ésta semana con todo y descansar....así a la vuelta tienen toda la energía. Si dios quiere falta menos para vernos!!!
No les doy más tarea para que terminen la última consigna ya que faltan muchos aún para entregar.
Los espero a todos en cada horario de su curso en el vivo de Instagram para cerrar ésta etapa.
Cariños a todo!!
________________________________________________________________________
7 de JULIO
2do Año:
Cómo están? Falta poco y se acercan las vacaciones de invierno, hemos terminado un nuevo tema y quiero felicitar a aquellos que mantuvieron el compromiso y la responsabilidad en las tareas y propuestas. Para cerrar éste recorrido les traigo una Actividad enriquecedora, trabajar en haciendo un mapa mental que integre todo lo trabajado desde comienzo de año entre dos alumnos.
Abrir el link y observar. Puedes editar con ese programa, aprendiendo a usarlo según tu investigación o si no te animas con el programa puedes copiarlo y luego de investigar como se debe hacer un mapa mental lo armas a mano enviando la foto correspondiente.
Abrir aquí
Como el trabajo es de a pares, pueden ponerse de acuerdo y organizarse para hacerlo.
Equipos:
1) Aguirre Benjamin con Fernandez Rosario
2) Correa Cristian con Ferreira Villareal Tiziana
3) Cuenca Tiago con Hours Victoria
4) Kupec David con Lagos Valentina
5) Paz Medina Ignacio con Layoia Keila
6) Quijano Mateo con Leonczik Maia
7) Quispe Emanuel con Massarella Angelina
8) Retamar Ian con Massarella Antonella
9) Sabbatella Felipe con Massarella Delfina
10) Wildemer Bruno con Mencia Pistachi Alma
11) Alegre Ada con Miño Luna
12) Alvarez Lucia Jimena con Obischuk Abigail
13) Barrera Ortiz Ariana con Sanchez Agustina
14) Cañete Abigail con Schillaci Bianca
15) Castillo Victoria con Tiscornia Lourdes
16) Cuevas Mía con Vernengo Sol
17) Esquivel Sofía con Viale Martinez Antonella
18) Vilarullo Iara con Zalazar Priscila
Deberán entregarlo vía mail a gisellabarua@hotmail.com antes del 17 de julio. La nota dependerá de la dedicación de encontrar las palabras más importantes, elegir imágenes o pegar imágenes, etc, lo más completo posible!!!
Por favor 1 sólo trabajo por equipo con el nombre de ambos deben entregar. Lo deberán tener ambos en la carpeta.
Cualquier duda lo pueden consultar en el vivo del miércoles a las 12 hs.
_______________________________________________________________________
3er Año:
Cómo están? Falta poco y se acercan las vacaciones de invierno, hemos terminado con hidróxidos y quiero felicitar a aquellos que mantuvieron el compromiso y la responsabilidad en las tareas y propuestas. Para cerrar éste recorrido les traigo una Actividad enriquecedora, trabajar en hacer un mapa mental que integre todo lo trabajado desde comienzo de año.
Abrir el link y observar. Puedes editar con ese programa, aprendiendo a usarlo según tu investigación o si no te animas con el programa puedes copiarlo y luego de investigar como se debe hacer un mapa mental lo armas a mano enviando la foto correspondiente.
Abrir aquí
Deberán entregarlo vía mail a gisellabarua@hotmail.com antes del 17 de julio. La nota dependerá de la dedicación de encontrar las palabras más importantes, elegir imágenes o pegar imágenes, etc, lo más completo posible!!!
Cualquier duda lo pueden consultar en el vivo del miércoles a las 12:30 hs.
________________________________________________________________________
5to Año:
Cómo están? Falta poco y se acercan las vacaciones de invierno, hemos terminado un nuevo tema y quiero felicitar a aquellos que mantuvieron el compromiso y la responsabilidad en las tareas y propuestas. Para cerrar éste recorrido les traigo una Actividad enriquecedora, trabajar en haciendo un mapa mental que integre todo lo trabajado desde comienzo de año.
Abrir el link y observar. Puedes editar con ese programa, aprendiendo a usarlo según tu investigación o si no te animas con el programa puedes copiarlo y luego de investigar como se debe hacer un mapa mental lo armas a mano enviando la foto correspondiente.
Abrir aquí
Deberán entregarlo vía mail a gisellabarua@hotmail.com antes del 17 de julio. La nota dependerá de la dedicación de encontrar las palabras más importantes, elegir imágenes o pegar imágenes, etc, lo más completo posible!!!
________________________________________________________________________
4to Año:
Cómo están? Falta poco y se acercan las vacaciones de invierno, hemos terminado un nuevo tema y quiero felicitar a aquellos que mantuvieron el compromiso y la responsabilidad en las tareas y propuestas. Para cerrar éste recorrido les traigo una Actividad enriquecedora, trabajar en haciendo un mapa mental que integre todo lo trabajado desde comienzo de año.
Abrir el link y observar. Puedes editar con ese programa, aprendiendo a usarlo según tu investigación o si no te animas con el programa puedes copiarlo y luego de investigar como se debe hacer un mapa mental lo armas a mano enviando la foto correspondiente.
Abrir aquí
Deberán entregarlo vía mail a gisellabarua@hotmail.com antes del 17 de julio. La nota dependerá de la dedicación de encontrar las palabras más importantes, elegir imágenes o pegar imágenes, etc, lo más completo posible!!!
______________________________________________________
1/7 Adjunto power point trabajados en las vídeo llamadas de:
2do año:
Gases ideales
3er año:
Hidróxidos
Por favor realizar la guía de ejercicios que se encuentra en la última hoja y lo corregimos la semana que viene en el Vivo.
_____________________________________________________
30 de Junio del 2020: Buenos días a todos...
Hola chicos, estoy con problema de conexión, revisen la plataforma que a medida que se pueda con datos del teléfono como ahora o que se resuelva estaré cargando las actividades durante el día. Gracias!
2do Año:
COPIAR EN LA CARPETA:
Estamos estudiando los gases ideales, pero, en que se diferencian con los gases reales?
Copiar lo que dice en la foto adjunta:
Mañana 12 hs los espero en un encuentro de zoom para corregir y cerrar el tema: Gases ideales. Tener los ejercicios realizados y los invito a participar en la vídeo llamada. Envío código a: abigailbelen2411@gmail.com
_______________________________________________________________________
3er Año:
COPIAR EN LA CARPETA:
Hemos corregido los ejercicios de óxidos y trabajado la nomenclatura para identificar que estado de oxidación se debe utilizar. Ahora es el momento de agregarle a los óxidos, agua, entonces cambia su composición, pero atención se debe diferenciar que:
Hay óxidos básicos formados por metales + O2 (oxígeno gaseoso)
Hay óxidos ácidos formados por no metales + O2 (oxígeno gaseoso)
Entonces:
Si a un óxido básico se le agrega H2O forma HIDRÓXIDO
Si a un óxido ácido se le agrega H2O forma ÁCIDO o también llamado OXOÁCIDO
Los invito a ver el siguiente vídeo:
Mañana los espero 12:50 para un encuentro por zoom donde reforzaré la explicación de éste nuevo compuesto y juntos realizaremos unos ejemplos. Así la próxima clase ya pueden realizar ejercicios solos. Pasaré el link de la vídeo llamada a lucy2307@hotmail.es
________________________________________________________________________
4to Año:
COPIAR EN LA CARPETA:
Ejercitación de Movimiento rectilíneo uniformemente variado:
No se entrega, en el vivo del jueves se hace la auto-corrección.
1) Se desea saber la posición final de un móvil que llega a una velocidad de 70 m/s, con una aceleración constante de 50 m/s2 en un tiempo de 320 minutos.
2) Calcular la posición final de un objeto que cae a una velocidad de 60m/s, donde su aceleración es la fuerza de gravedad (9,8 m/s2) en un tiempo de 6 minutos.
3) Se desea saber la posición final de un móvil que llega a una velocidad de 80m/s, con una aceleración constante de 40m/s2 en un tiempo de 2.3 horas.
4) Calcular la posición final de un objeto que cae a una velocidad de 35m/s, donde su aceleración es la fuerza de gravedad (9,8 m/s2) en un tiempo de 12 segundos
5) Se desea saber la posición final de un móvil que llega a una velocidad de 120 m/s, con aceleración constante de 50 m/s2 en un tiempo de 2.35 horas.
________________________________________________________________________
5to Año:
COPIAR EN LA CARPETA:
Compuestos nitrogenados
| ||
|
Los compuestos con grupos funcionales nitrogenados son los siguientes: Aminas, que tiene gran importancia en los seres vivos y las Amidas.
Porqué son importantes para los seres vivos?
| Investiga, escribe en la carpeta, en el vivo del jueves 12:30 hs lo trabajaremos!! |
23 de Junio 2020
2do Año:
COPIAR EN LA CARPETA:
Actividad:
Realizar los siguientes ejercicios:
Recordar lo trabajado en el VIVO de la semana pasada
1) Calcular la presión de 2 moles de gas Radón que se encuentran en un volumen de 0.8 litros a una temperatura de 323 Kelvin.
2) Se desea saber la temperatura de un sistema formado por 1,8 moles de gas Xenón que se encuentran en un volumen de 1.5 litros a una presión de 1,2 atmósferas.
3) Cuantos moles de gas Helio hay en un sistema que posee una temperatura de 398 kelvin, una presión de 2.3 atmósferas y un volumen de 2.2 litros.
4) Calcular la presión de 3 moles de gas Helio que se encuentran en un volumen de 3 litros a una temperatura de 273 Kelvin.
5) Se desea saber la temperatura de un sistema formado por 2.55 moles de gas Neón que se encuentran en un volumen de 2 litros a una presión de 1,25 atmósferas.
6) Cuantos moles de gas Criptón hay en un sistema que posee una temperatura de 290 kelvin, una presión de 1.3 atmósferas y un volumen de 2.5 litros.
7) Calcular la presión de 1.60 moles de gas Argón que se encuentran en un volumen de 1.85 litros a una temperatura de 310 Kelvin.
8) Se desea saber la temperatura de un sistema formado por 5 moles de gas Xenón que se encuentran en un volumen de 2.5 litros a una presión de 2 atmósferas.
9) Cuantos moles de gas Radón hay en un sistema que posee una temperatura de 280 kelvin, una presión de 1.8 atmósferas y un volumen de 2.5 litros.
10) Calcular la presión de 2 moles de gas Helio que se encuentran en un volumen de 1.45 litros a una temperatura de 298 Kelvin.
Realizar los ejercicios y auto-corregimos en la próxima semana.
Mañana en el Vivo a las 12 hs trabajaremos el trabajo investigado por Ley de Gay Lussac
La fórmula resultado de su trabajo fue:
3er Año:
COPIAR EN LA CARPETA:
Estamos trabajando óxidos, donde el oxígeno como reactivo se encuentra en estado gaseoso (O2) pero como producto en otro estado (O).
Qué es el estado de oxidación? es la suma de cargas eléctricas positivas y negativas de un átomo, lo cual indica el número de electrones que tiene el átomo y que pone en juego en una ecuación química. Cuando se obtiene un producto se analizan los estados de oxidación buscando su neutralización.
Todos los átomos tienen un estado de oxidación?
NO:
- Pueden tener un estado de oxidación como por Ej: Sodio
Entonces al reaccionar con oxígeno se denominará ÓXIDO de SODIO
- Pueden tener 2 estados de oxidación como por Ej: Hierro
Entonces al reaccionar con oxígeno como se denominará?
Pues, si se utiliza el estado de oxidación más pequeño se llamará Óxido Ferroso y si se utiliza el estado de oxidación más grande se llamará Óxido Ferrico. Por eso atención!
- Pueden tener 3 estados de oxidación como por Ej: Cromo
Entonces al reaccionar con oxígeno como se denominará?
Pues, si se utiliza el estado de oxidación más pequeño se llamará Óxido hipocromoso, si se utiliza el estado de oxidación del medio se llamará Óxido Cromoso y si se utiliza el estado de oxidación más grande se llamará Óxido Cromico. Por eso atención!
- Puede tener 4 estados de oxidación por Ej: Cloro
Pues, si se utiliza el estado de oxidación más pequeño se llamará Óxido hipocloroso, si se utiliza el 2do estado de oxidación se llamará Óxido Cloroso, si se utiliza el 3er estado de oxidación se llamará Óxido Clorico y si se utilizara el estado de oxidación más grande se llamará Óxido Perclorico. Por eso atención!
Actividad: Realizar los siguientes óxidos:
1) óxido Arsénico
2) óxido Rodioso
3) óxido Perbromico
No entregar. Mañana 12:30 hs en el VIVO lo voy a explicar y auto-corregimos juntos!
________________________________________________________________________
4to Año:
COPIAR EN LA CARPETA:
MOVIMIENTO RECTILÍNEO UNIFORMEMENTE VARIADO: M.R.U.V
Un cuerpo realiza M.R.U.V cuando su trayectoria es una línea recta y su aceleración es constante. La velocidad varía de cero y lo realiza en un determinado tiempo. Su fórmula es:
Realizar los siguientes ejercicios:
1) Se desea saber la posición final de un móvil que llega a una velocidad de 90 m/s, con una aceleración constante de 50 m/s2 en un tiempo de 1.5 horas.
2) Calcular la posición final de un objeto que cae a una velocidad de 45 m/s, donde su acelación es la fuerza de gravedad (9,8 m/s2) en un tiempo de 55 segundos.
No entregar. El jueves a las 12 hs en el VIVO explicaré el tema y auto-corregiremos los ejercicios.
_______________________________________________________________________
5to Año:
COPIAR EN LA CARPETA:
Con todo lo trabajado en el VIVO pasado intenta realizar los siguientes ejercicios de oxigenados.
1ero estabilizar la cadena con hidrógenos
2do buscar la cadena principal y numerarla.
3ero nombrar la cadena
No entregar. El jueves a las 12:30 hs en el VIVO contestaré dudas y auto-corregiremos los ejercicios. Los espero! Por ahora no haremos zoom.
________________________________________________________________________
18 de Junio
4to año:
Respuestas de ejercicios auto-corregidos con sólo 11 alumnos presentes.
1) 1080000 metros
2) 810000 metros
3) 1545600 metros
Es lamentable que no todos hayan aprovechado el vivo. Les pido re pensar la responsabilidad ante las actividades. Saludos!
16 de Junio 2020
2do Año:
COPIAR EN LA CARPETA:
Buenos días, retomamos el estudio de los gases ideales, realizaron un trabajo (que estoy corrigiendo, disculpen la demora) sobre los científicos que elaboraron hipótesis e hicieron demostraciones a través de experiencias y fórmulas matemáticas. Todas las leyes investigadas se integran en una fórmula general que es la siguiente:
Vamos a analizar cada una de las variables:
P: significa PRESIÓN, que se mide en atmósferas, su unidad es: atm.
V: significa VOLUMEN, que se mide en litros, su unidad es: l
n: significa mol, que es la cantidad de materia involucrada, su unidad es: mol
T: significa temperatura, se mide siempre en Kelvin, su unidad es: K
Cómo ven R no es una variable, sino un número fijo que es: 0.082 y su unidad es atm.l
mol. K
Cada una de las variables hablando matemáticamente se pueden despejar y por lo tanto averiguar, eso significa que a partir de ahora les daré ejercicios donde calcular una incógnita determinada.
Recuerden que los gases ideales son los del grupo 18 de la tabla periódica, por si en algún ejercicio les pongo algún nombre determinado.
Ejemplo: Calcular el volumen de un sistema de gas ideal de 3 moles de Helio que se encuentra en 6 atmósferas de presión y a una temperatura de 353 Kelvin.
Explicación del ejemplo:
ver aquí
Actividad: Realizar los siguientes ejercicios:
1) Calcular la presión de 4 moles de gas Xenón que se encuentran en un volumen de 1.5 litros a una temperatura de 298 Kelvin.
2) Se desea saber la temperatura de un sistema formado por 2 moles de gas Argón que se encuentran en un volumen de 2.8 litros a una presión de 4 atmósferas.
3) Cuantos moles de gas Helio hay en un sistema que posee una temperatura de 320 kelvin, una presión de 1.5 atmósferas y un volumen de 3 litros.
______________________________________________________________________
3er Año:
COPIAR EN LA CARPETA:
Hemos trabajado óxidos, también lo hemos explicado en el vivo. Ver el vídeo adjunto donde repaso la neutralización de las cargas del producto y el balanceo colocando números estequiometricos para tener la misma cantidad de reactivos que de productos.
Abrir aquí vídeo correcto
COPIAR EN LA CARPETA:
Movimiento Rectilíneo uniforme:
Actividad: Resolver los siguientes ejercicios con la fórmula de MRU:
1) ¿Cuál será la posición final de una moto que viaja a una velocidad de 120 m/s en 2 horas y media?
2) Un comerciante sale en automóvil a las 14 p.m a una velocidad de 180 m/s llegando al trabajo a las 15:15 p.m. Averiguar la posición final.
3) Un carro es trasladado por una moto a 80 m/s de velocidad y demorando 322 minutos en llegar a la meta. Cuál fue la posición final?
En el vivo del jueves 12 hs haremos la auto-corrección de los ejercicios. Es importante participar del mismo. La semana siguiente empezamos con el Movimiento rectilíneo uniformemente variado y esa semana tendremos un un zoom.
_______________________________________________________________________
5to Año:
COPIAR EN LA CARPETA:
Grupos oxigenados: A continuación el cuadro de 4 grupos oxígenados trabajados en la investigación enviada:
En el vivo del jueves 12:30 hs explicaré los 4 grupos funcionales, incluso la diferencia y semejanza de cada uno. Es importante la participación. La semana siguiente seguramente tendremos un encuentro en zoom.
_______________________________________________________________________
2do Año:
Estamos cerrando un recorrido juntos, un 1er trimestre donde vimos muchos aprendizajes nuevos y nos hemos acompañado en una situación inédita tanto como país como a nivel mundial. Realizar la siguiente auto-evaluación y enviarla por mail antes del 15 de Junio a gisellabarua@hotmail.com
Luego continuaremos trabajando con los contenidos ya presentados....
Mañana en el vivo me preguntan dudas.
3er Año:
Estamos cerrando un recorrido juntos, un 1er trimestre donde vimos muchos aprendizajes nuevos y nos hemos acompañado en una situación inédita tanto como país como a nivel mundial. Realizar la siguiente auto-evaluación y enviarla por mail antes del 15 de Junio a gisellabarua@hotmail.com
Luego continuaremos trabajando con los contenidos ya presentados....
Mañana en el vivo me preguntan dudas.
AUTO EVALUACIÓN ABRIR AQUÍ
____________________________________________________________________________________________________________
4to Año:
Estamos cerrando un recorrido juntos, un 1er trimestre donde vimos muchos aprendizajes nuevos y nos hemos acompañado en una situación inédita tanto como país como a nivel mundial. Realizar la siguiente auto-evaluación y enviarla por mail antes del 15 de Junio a gisellabarua@hotmail.com
Luego continuaremos trabajando con los contenidos ya presentados....
El jueves en el vivo me preguntan dudas.
AUTO EVALUACIÓN ABRIR AQUÍ
____________________________________________________________________________________________________________
5to Año:
Estamos cerrando un recorrido juntos, un 1er trimestre donde vimos muchos aprendizajes nuevos y nos hemos acompañado en una situación inédita tanto como país como a nivel mundial. Realizar la siguiente auto-evaluación y enviarla por mail antes del 15 de Junio a gisellabarua@hotmail.com
Luego continuaremos trabajando con los contenidos ya presentados....
El jueves en el vivo me preguntan dudas.
AUTO EVALUACIÓN ABRIR AQUÍ
________________________________________________________________________
2 de Junio 2020
Buenos días, como están?
2do Año:
Copiar en la Carpeta:
Hemos trabajado soluciones en estado líquido de la materia respecto del solvente y considerando el soluto como materia sólida. También sabemos que la concentración del soluto hace que la solución cambie siendo diluida, concentrada, saturada o sobre saturada. Ahora vamos a trabajar con el estado gaseoso, los gases ideales. Pero, a qué se denomina gas ideal? Es un gas teórico, es decir imaginario, estable que se lleva a cabo en un laboratorio compuesto de partículas que se mueven por todo el volumen sin interactuar entre sí.
Diferentes científicos han estudiado a los gases ideales para comprender como actúan los gases reales.
Actividad: Investigar sobre las leyes de los gases ideales, registra sus ecuaciones y dibujos.
Enviar por mail a gisellabarua@hotmail.com antes del 8 de junio.
________________________________________________________________________
3er Año:
Copiar en la Carpeta:
Toda transformación química se representa mediante una ecuación química, que es la representación simbólica de dicha transformación.
Para poder interpretar la estructura de los compuestos químicos y poder escribir correctamente sus fórmulas es necesario comprender el concepto de número de oxidación.
Se denomina número de oxidación de un elemento en una sustancia al número de electrones que un átomo cede o tiende a ceder en una unión química.
Los compuestos químicos se clasifican en: binarios, ternarios, cuaternarios, etc, según el número de elementos que formar dicha molécula.
Compuestos binarios: Son aquellos que están formados por dos elementos; entre los compuestos binarios se destacan los óxidos.
Formación de los óxidos.
Los óxidos se forman por la combinación de un elemento metálico o no metálico y el oxígeno. Los óxidos pueden ser básicos o ácidos según estén formados por un metal o un no metal respectivamente.
Metal + Oxígeno → Óxido básico
No Metal + Oxígeno → Óxido ácido
Ecuación de formación de un óxido básico: En toda ecuación química se escriben en el primer miembro las fórmulas de las sustancias reaccionantes y en el segundo miembro las fórmulas de los productos de la reacción: Por ejemplo si se combina el calcio con el oxígeno, la ecuación queda expresada así:
Ca + O2 → CaO
Para poder escribir correctamente un compuesto se debe conocer el o los números de oxidación de los elementos que forman la molécula, dicha información se encuentra en la tabla periódica.
Para tener en cuenta: el número de oxidación del oxígeno combinado siempre es -2. La molécula que se forma es electricamente neutra, por lo tanto la suma de los números de oxidación de los elementos que la constituyen multiplicados por los respectivos subíndices debe ser igual a cero.
Por lo tanto si el número de oxidación del calcio combinado es +2 nuestra ecuación quedaría: Ca + O2 → CaO Empleando nºde oxidación:Ca +2 O -2 (+2-2=0 )
Otro ejemplo:
El caso del potasio: K +1 y el O -2
Para que la especie sea eléctricamente neutra debemos tener otro átomo de potasio que lo indicaremos con un subíndice y así obtener dos cargas positivas; la ecuación sería así:
K + O2 → K 2 O K2 +1 O -2 (+2-2=0)
Pero atención, las ecuaciones se deben balancear para que haya misma cantidad de átomos de reactivos que de átomos de producto. La forma que existe para balancear es el método de tanteo entre otros.
Observemos la ecuación del óxido de calcio, en el primer miembro o sustancias reaccionantes tenemos un átomo de calcio y dos átomos de oxígeno, mientras que en el producto tenemos un átomo de calcio combinado con un átomo de oxígeno, como no podemos modificar los subíndices llamados atomicidad, debemos agregar coeficientes estequiométricos que son los factores que multiplican a toda la fórmula (números grandes).
2 Ca + O2 → 2 CaO
Agrego Coeficientes estequiométricos (multiplicación)
Otro ejemplo: el óxido de potasio, en el primer término tenemos un átomo de potasio y dos átomos de oxígeno, mientras que en el producto de la reacción tenemos dos átomos de potasio y un átomo de oxígeno, por lo tanto debemos agregar los coeficientes de multiplicación
4 K + O2 → 2 K2O
Agrego Coeficientes estequiométricos
Los espero en el vivo el miércoles 12:30 hs así les explico ésta teoría con la pizarra. Deberán tener todo copiado y leído así mientras explico me escriben las consultas.
________________________________________________________________________
4to Año:
Copiar en la Carpeta:
Movimiento Rectilíneo uniforme
Es el movimiento que describe un cuerpo a través de una línea recta a una velocidad constante. El movimiento es lineal desde una posición inicial, con una velocidad determinada y en un cierto tiempo. Fórmula:
La posición inicial siempre es 0 porque está en reposo. La posición final (x) tiene unidad metro, La velocidad tiene unidad m/s y el tiempo tiene unidad segundos.
Ejemplo: Calcular la posición final de un móvil que partió de un estado de reposo a una velocidad constante a 120 m/s y demoró en llegar a la meta 1 hora 15 minutos.....Pensalo y resolvelo con la fórmula. El jueves en el vivo 12 hs lo explico así te paso una lista de ejercicios.
______________________________________________________________________
5to Año:
Copiar en la Carpeta:
Compuestos oxigenados
26 de MAYO del 2020
Buenos días a todos chicos, ésta semana estaremos encontrándonos por vídeo llamada con 2do año el 27/5 12 hs
3er año el 27/5 12:50hs
4to año el 28/5 12 hs
5to año el 28/5 12:50 hs
Hoy estaré enviando mail a los referentes de 2do y 3er año con el link de ingreso y mañana les estaré enviando mail a los referentes de 4to y 5to con el link de ingreso.
Normas de seguridad:
- No deben pasar el link a nadie que no sea del curso
- Deben ingresar con su nombre y apellido a la sala de espera y esperar ser admitidos
- Deben mantener la cámara encendida y los micrófonos apagados
- Es importante mantener en la vídeo llamada siempre el respeto
- La participación será levantando la mano, pidiendo la palabra a través de sticker o cuando la profesora los nombre.
2do año:
12 de MAYO del 2020
2do año:
Copiar en la Carpeta
Las soluciones químicas pueden clasificarse de acuerdo a la proporción que exista entre soluto y solvente, denominada concentración. Existen, así, cuatro tipos de soluciones:
Materiales: 4 vasos de vidrio transparente, agua, azúcar, cucharita, microondas o cocina.
Vaso 1: Colocar el vaso lleno de agua y agregarle 1 cucharadita de azúcar y mezclar.
Vaso 2: Colocar el vaso lleno de agua y agregarle 3 o 4 cucharaditas de azúcar y mezclar.
Vaso 3: Colocar el vaso lleno de agua y agregarle cucharaditas de azúcar hasta mezclar y ver una solución a la vista cargada de azúcar pero no precipita o cae nada en el fondo.
Vaso 4: Colocar el vaso lleno de agua y agregarle muchas cucharaditas de azúcar, poner a calentar y mezclar, ver que se disuelve con la temperatura y agregarle más. Luego dejar enfriar.
REGISTRAR EN LA CARPETA LO QUE SE OBSERVA DE LOS 4 VASOS Y COMPROBAR CON LA TEORÍA.
MAÑANA EN EL VIVO 12 hs los espero para conversar sobre la teoría que envío, sobre el vídeo y sobre la experiencia donde son Uds quienes comentarán.
No se entrega ésta tarea!!!!!
________________________________________________________________________
3er año:
Copiar en la Carpeta
4to año
Copiar en la Carpeta
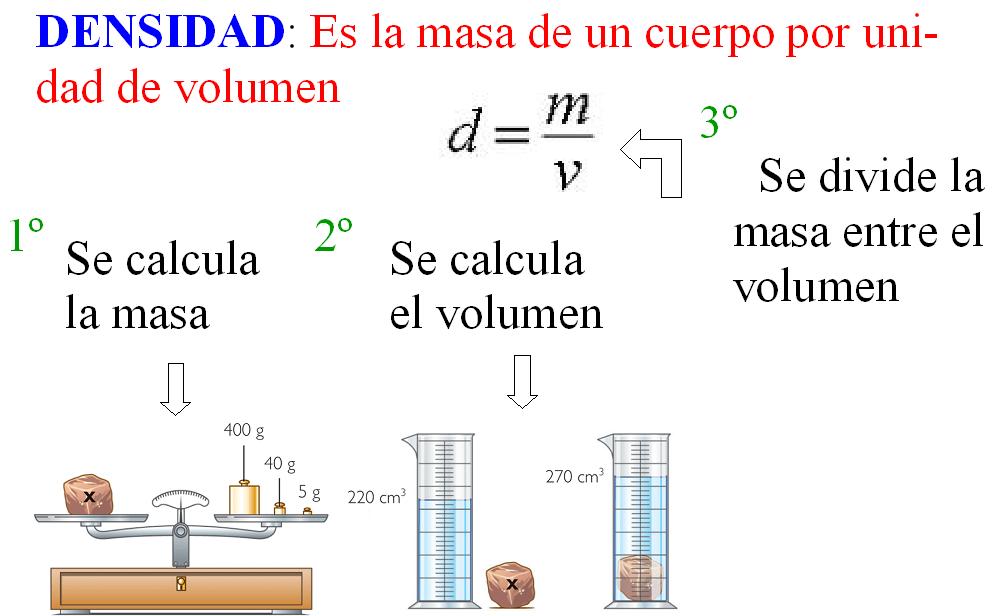

a) Calcular el tiempo que demora un móvil en recorrer una distancia de 250 kilómetros a una velocidad de 80m/s. La respuesta debe estar en horas.
b) Calcular la densidad de un cuerpo que tiene una masa de 35 kg y un volumen de 2850 cm3.
Copiar en la Carpeta
Se conoce como alquenos a un tipo de hidrocarburos en cuyas moléculas es posible encontrar 1 enlace doble entre carbono=carbono, en algún lugar de la cadena.
La fórmula general de los alquenos es CnH2n, donde N representa la cantidad de los átomos respectivos.
Siempre se indica antes de poner el nombre de la cadena el número de carbono donde empieza el doble enlace.
Son insolubles en agua, pero solubles en solventes orgánicos, tales como el alcohol y el éter. Los puntos de fusión y de ebullición son algo más bajo y la densidad un poco más elevada que la de los alcanos de igual número de átomos de carbono.
ACTIVIDAD:
Guiándose con la nomenclatura de los alcanos y teniendo en cuenta ésta nueva teoría de los alquenos intenta nombrar y sacar la fórmula molecular del siguiente ejercicio:
5to año:
Copiar en la Carpeta
RAMIFICACIONES Y NOMENCLATURA:
Siguiendo con hidrocarburos, más específicamente con alcanos debemos tener en cuenta que las cadenas no son sólo lineales (como armaron el cuadro), los carbonos en la naturaleza se unen formando cadenas con ramificaciones, entonces a partir de ahora incluiremos las ramificaciones o grupos alquilo.
Se denomina así a las unidades estructurales de moléculas orgánicas que tienen 1 hidrógeno menos para estar estable porque la cuarta unión la tiene con la cadena principal. Pueden ser:
-CH3 llamado "METIL"
-CH2-CH3 llamado "ETIL"
-CH2-CH2-CH3 llamado "PROPIL"
Todas las cadenas posee su nombre o también llamado Nomenclatura, para realizarlo correctamente se deben tener en cuenta los siguientes ítems:
1- Se elige la cadena principal que siempre tiene la mayor cantidad de carbonos.
2- Se enumeran los carbonos de la cadena principal iniciando desde el lado donde se encuentra la ramificación más cercana.
3- A todos los carbonos se los completa con hidrógenos para que estén estables, recordar que cada átomo de carbono debe tener 4 uniones para ser estable.
4- Se nombra: primero las ramificaciones en orden alfabético y si se repiten se coloca delante los prefijos DI, TRI, TETRA, PENTA, HEXA, etc.
5- Se nombra la cadena principal.
6- A través de la fórmula de alcanos Cn H2.n + 2 se forma la fórmula molecular.
Observar tutorial de la explicación del tema:
MIRAR AQUÍ
Realizar los siguientes ejercicios PARA ENTREGAR EL 11 DE MAYO POR MAIL A gisellabarua@hotmail.com
4to año dejo foto de los ejercicios de la semana anterior para que puedan hacer la auto-corrección:
COPIAR EN LA CARPETA:
Para terminar con las unidades simples del sistema internacional de unidades deben saber:
La Unidad de corriente denominada amper (A): es la cantidad de electrones que viajan por un circuito a través de conectores mediante el interruptor. Posee una intensidad, un voltaje que puede estar segmentado, las resistencias, los cables (conectores) y el interruptor. Puede haber 3 tipo de circuitos: simples, paralelos y mixtos) tema trabajado en 2do año.
Intensidad luminosa: Candela
La velocidad de la luz en el vacío es por definición una constante universal de valor: 29979248 metros sobre segundos. La velocidad por tiempo de recorrido de la luz entre el sol y la tierra es de 300000 kilómetros por segundo. La unidad es candela que significa en latín rapidez. La intensidad luminosa sucede en una dirección dada de una fuente que emite una radiación monocromática.
TRABAJO PRÁCTICO PARA ENTREGAR EL 11 DE MAYO POR MAIL A gisellabarua@hotmail.com
Resolver los siguientes ejercicios de unidades simples:
1) Pasar 1235 Hectogramo a centigramo
2) Sacar los gramos totales del siguiente ácido H2SO4 y luego pasar el resultado a decagramo.
3) Cuántos metros hay en 15356230 milímetros?
4) Calcular la cantidad de sustancia en gramos, moles y moléculas que posee la siguiente ecuación:
Al (OH)3 + 3 H Cl ----- Al Cl3 + 3 H2O
________________________________________________________________________
2do año:
COPIAR EN LA CARPETA:
Donde figuran todos los elementos químicos conocidos por la humanidad?
Se encuentran en la tabla periódica. En principio, toda la materia conocida del universo estaba compuesta por diversas combinaciones de los elementos que hasta ahora se reconocen 18 elementos distintos. El ordenamiento fue realizado por el científico Dimitri Mendeleiv quien desde el comienzo trabajo buscando un orden de peso atómico creciente aunque algunos quedaron fuera y los fue ubicando acorde a sus propiedades físicas y químicas. Al poco tiempo otros científicos descubrieron elementos estables, llamados gases inertes) y así se crea un nuevo y último grupo. En 1913 al incorporar la idea de número atómico, que coincidía con la cantidad de protones y electrones del átomo, Mendeleiv resolvió el problema del orden ubicando a lo átomos de manera creciente. La unión internacional de química pura y aplicada hoy reconoce 114 elementos y se sabe que existen otros pero aún no fueron incluídos.
Período: es el nro de renglón o nro de órbitas que tiene cada átomo, es vertical y va del 1 al 7.
Grupo: es el número de columnas, mismas características físicas que tienen en común los átomos, es horizontal y va desde el 1 al 18.
TRABAJO PRÁCTICO PARA ENTREGAR EL 11 DE MAYO POR MAIL A gisellabarua@hotmail.com
B) Escribe la biografía de Mendeleiv. Investiga cómo ordenó los elementos a medida que iba pasando el tiempo hasta llegar a la tabla periódica actual.
________________________________________________________________________
3er año:
COPIAR EN LA CARPETA:
TRABAJO PRÁCTICO PARA ENTREGAR EL 11 DE MAYO POR MAIL A gisellabarua@hotmail.com
1) Siguiendo la configuración electrónica descubrir que elemento es:
a- 5p4
b- 6d8
C- 5f10
2) Ahora que los descubriste escribir completa la configuración electrónica de todos los ítem del punto 1.
3) Investigar:
a- Qué son las uniones químicas?
b- Todo sobre la molécula de agua respecto de la química
________________________________________________________________________
Dejo por aquí la foto de la tabla periódica para aquellos que no la tienen:
28 de Abril del 2020
ATENCIÓN:
Ésta semana recuerden que haremos en los vivos de Instagram las auto-correcciones de los ejercicios que tuvieron que realizar con ayuda de los tutoriales, es importante que todos participen en el vivo ya que será parte de la calificación. Tengan el compromiso de tenerlos realizado en la carpeta para que puedan afianzar el aprendizaje.
Horarios a estar atentos:
- Miércoles 29/4 de 12 a 12:30 hs sólo 2 año
- Miércoles 29/4 de 12:30 a 13 hs sólo 3er año.
- Jueves 30/4 de 12 a 12:30 hs sólo 4to año.
- Jueves 30/4 de 12:30 a 13 hs sólo 5to año.
Les pido por favor que ingresen en el horario correspondiente y se retiren en el horario que no les corresponde.
Muchas Gracias!
21 de Abril del 2020
5to año:
Copiar en la carpeta: El átomo de carbono es el principal componente de los restos fósiles (petróleo) que al combinarse con otros elementos forma una gran variedad de compuestos que desempeñan funciones fundamentales para la vida y la Tierra. Del petróleo surgen los hidrocarburos que son compuestos químicos formados por átomos de carbono e hidrógeno que intervienen en múltiples industrias, desde la aeronáutica a la industria del juguete. Casi todos los combustibles que se utilizan en el transporte son derivados de hidrocarburos, uso por el que crean desechos contaminantes (dióxido de carbono). Por ello, actualmente se intenta reemplazarlos con otros tipos de combustibles y fuentes de energía.
Los hidrocarburos son un recurso no renovable, ya que no pueden ser fabricados por el ser humano. Pueden clasificarse en:
- El punto de ebullición aumenta con el tamaño del alcano porque las fuerzas intramoleculares son más efectivas cuanto mayor es la superficie de la molécula.
- Solubilidad y densidad: Los alcanos son apolares, por lo que se disuelven en disolventes orgánicos apolares o débilmente polares. Se dice que son hidrofóbicos (repelen el agua) ya que no se disuelven en agua. Los alcanos son casi totalmente insolubles en agua debido a su baja polaridad y a su incapacidad para formar enlaces con el hidrógeno. Lo que se refiere a la densidad, cuanto mayor es el número de carbonos las fuerzas intermoleculares son mayores y la cohesión intermolecular aumenta, resultando en un aumento de la proximidad molecular y, por tanto, de la densidad. Son menos densos que el agua.
- Concepto de homología Una serie de compuestos cuyos miembros difieren del siguiente en un valor constante se denomina serie homóloga, y sus miembros son homólogos. La familia de los alcanos forma tal serie homóloga, siendo la diferencia constante entre miembros sucesivos igual a CH2. También apreciamos que en cada uno de los alcanos, el número de hidrógenos es el doble más 2 del número de átomos de carbono, por lo que podemos escribir una fórmula general para sus miembros, que es CnH2n+2. El primer representante es el metano, de fórmula CH4.n.
__________________________________________________________________________
21 de Abril del 2020
3er año:
Copiar en la carpeta:
Configuración electrónica
Es la disposición de todos los electrones de un elemento en los niveles y subniveles energéticos (orbitales). El llenado de éstos orbitales se produce en orden creciente de energía, es decir, desde los orbitales de menor energía hacia los de mayor energía.


Ejemplo1:
Observar el tutorial que explica el tema completo son varios vídeos.
TUTORIALES 3ero ABRIR AQUÍ
Luego realizar la configuración electrónica de los siguientes elementos:
Plata:
Germanio:
Antimonio:
Bismuto:
No se envía la tarea, luego auto-corregimos, mañana en el vivo explicaré como lo haremos la semana que viene.
_________________________________________________________________
21 de Abril del 2020
4to año:
Copiar en la carpeta:
LA CANTIDAD DE SUSTANCIA Y SU UNIDAD EL MOL
2do año:
Copiar en la carpeta:
En el asunto: año y materia
En el encabezado del trabajo colocar nombre y apellido y luego pegar la producción terminada.
Las consultas las pueden realizar por mail antes de la fecha de entrega.
Al normalizar las clases deberá estar el trabajo en la carpeta pegado.
2do año Físico Química
Leer encabezado para enviármelo hasta el 24/3 inclusive.
Descargar aquí el trabajo
Mirar el vídeo (hacer click en cambios de la materia y aparecerá el enlace). Luego resolver los ejercicios. cambios de estados de la materia
_______________________________________________________________
Leer encabezado para enviármelo hasta el 24/3 inclusive. 3er año Físico Química
Descargar aquí el trabajo
Luego de descargar el trabajo, leer bien la consigna y resolver los ejercicios.
________________________________________________________________
Leer encabezado para enviármelo hasta el 24/3 inclusive.
4to año INTRODUCCIÓN A LA FÍSICA
Descargar aquí el trabajo
Luego de descargar el trabajo, leer bien la consigna y resolver los ejercicios.
_______________________________________________________________
Leer encabezado para enviármelo hasta el 24/3 inclusive.
5to año INTRODUCCIÓN A LA QUÍMICA
Descargar aquí el trabajo
Luego de descargar el trabajo, leer bien la consigna y resolver los ejercicios.
Para analizar y responder “Derrame de petróleo en el Golfo de MÉXICO”
Les recomiendo mirar la película completa llamada "Horizonte profundo"
________________________________________________________
Chicos les adjunto algunos vídeos con explicaciones rápidas que seguramente les ayudará a evacuar dudas. Saludos
_________________________________________________________________________________________________________
actividad de 3er año nuevamente lo subo
Hoy en el vivo me dijeron que no estaban cargadas las actividades para 3er año, lo vuelvo a subir, ojalá ya lo puedan resolver.
Saludos
______________________________________________________________________________________________________
Adjunto les paso la explicación para 5to año sobre como realizar óxidos, hidróxidos y ácidos. Con éstos vídeos van a poder recordar.
LEER 2do, 4to y 5to año el encabezado es igual para todos, luego buscar el curso correspondiente y copiar todo.
La producción debe ser individual y propia (tendré muy presente que así lo sea). La fecha de entrega será como último día el jueves 2 de abril inclusive. La forma de entrega será vía mail a: gisellabarua@hotmail.com
En el asunto: año y materia
En el encabezado del trabajo colocar nombre y apellido y luego pegar la foto de la producción terminada.
NO DEBEN ENVIARME A GMAIL!!!!!!
Aclaraciones: Debe realizarse en lapicera, usar colores, prolijo, poner datos de las fuentes consultadas, a mano en la carpeta. Luego de haber observado la entrega anterior les pido tengan en cuenta no dejarlo para último momento, las investigaciones deben ser completas y respetar lo que pido en la consigna.
___________________________________________________________
2DO AÑO
Cantidad física
|
Unidad
|
Símbolo
|
Longitud
|
Metro
|
m
|
Masa
|
Kilogramo
|
Kg
|
Tiempo
|
Segundos
|
s
|
Temperatura
|
Kelvin
|
K
|
Cantidad
de sustancia
|
Mol
|
mol
|
Intensidad
de corriente
|
Amperio
|
A
|
Intensidad
luminosa
|
Candela
|
Cd
|
______________________________________________________
3er AÑO
Leer el encabezado resaltado de celeste y luego realizar lo que dice a continuación:
____________________________________________________________________________________________________________
- EL RADIO ATÓMICO: aumenta el tamaño de los átomos cuánto más a la izquierda y hacia abajo se encuentra ubicado en la tabla periódica. Ejemplo el Francio tiene más radio atómico que el Hierro.
- LA ELECTRONEGATIVIDAD: aumenta cuando el elemento se ubica bien a la derecha y hacia arriba. Los gases inertes al ser estables no tienen electronegatividad. Ejemplo: El flúor tiene más electronegatividad que el Cinc.
- LA ENERGÍA DE IONIZACIÓN: aumenta igual que la electronegatividad y tiene lógica porque la energía provoca el acercamiento de los átomos y con la electronegatividad se logra la captación.
En la última actividad virtual han realizado una infografía sobre cada una de las unidades simples del cuadro del sistema internacional de unidades.
Ejercicio: con ayuda del trabajo anterior resuelve los siguientes pasajes:
1) Cuántos metros hay en 120 kilómetros?
2) Cuántos centímetros son 18 hectómetros?
3) Cuántos decámetros hay en 1503 milímetros?
4) Cuántos metros son 1,6 kilómetros?
5) Cuántos gramos hay en 6,1 Kilogramos?
6) Cuántos gramos hay en 12 decagramos?
7) Cuántas segundos hay en 105 minutos?
8) Cuántas horas hay en 6350 segundos?
9) Cuántos kelvin son 25 celsius?
10) Cuántos celsius son 278 kelvin?
Ayuditas: En una hora hay 60 minutos y 3600 segundos
En 1 kilogramo hay 1000 gramos
En 1 Kilómetro hay 1000 metros
Para pasar de kelvin a celsius se le resta 273 al kelvin
Para pasar de celsius a kelvin se le suma 273 al celsius.
____________________________________________________________________________________________________________
5to AÑO
Ejercicio: Dibujar la torre de fraccionamiento con los productos de la destilación del petróleo y escribe "brevemente" o "en forma de ítem" el método de destilación del petróleo.
Con ésto terminamos con la teoría de PETRÓLEO. a prepararse para la práctica!!!
_________________________________________________________________________________
13 de ABRIL2do AÑOBuenos días alumnos, vamos a realizar la auto-corrección o auto-evaluación del trabajo práctico realizado la semana pasada que NO tenía fecha de entrega y que Uds deben tener realizado en la carpeta.
La auto-corrección es una instancia de aprendizaje donde se afianzan los nuevos conocimientos, por ello es importante llevarla adelante. Los invito a chequear con su carpeta observando el vídeo que les preparé, lo que tiene mal no borrar, sino tachar y colocar lo correcto para que de esa manera uds reconozcan los errores.
________________________________________________________________________________
3er AÑOBuenos días alumnos, vamos a realizar la auto-corrección o auto-evaluación del trabajo práctico realizado la semana pasada que NO tenía fecha de entrega y que Uds deben tener realizado en la carpeta.
La auto-corrección es una instancia de aprendizaje donde se afianzan los nuevos conocimientos, por ello es importante llevarla adelante. Los invito a chequear con su carpeta observando el vídeo que les preparé, lo que tiene mal no borrar, sino tachar y colocar lo correcto para que de esa manera uds reconozcan los errores.
______________________________________________________________________________
4to AÑO Buenos días alumnos, vamos a realizar la auto-corrección o auto-evaluación del trabajo práctico realizado la semana pasada que NO tenía fecha de entrega y que Uds deben tener realizado en la carpeta.
La auto-corrección es una instancia de aprendizaje donde se afianzan los nuevos conocimientos, por ello es importante llevarla adelante. Los invito a chequear con su carpeta observando el vídeo que les preparé, lo que tiene mal no borrar, sino tachar y colocar lo correcto para que de esa manera uds reconozcan los errores.
Aclaración: el ejercicio 2 lo repito correctamente en el vídeo nro 2, disculpen la confusión:
_________________________________________________________________________________
5to AÑO Buenos días alumnos, vamos a realizar una una actividad de afianzamiento de toda la teoría trabajada. La idea es unificar todo sobre un mismo tema: "El petróleo". Para ello deberán realizar un cuadro integrador de conceptos. Les recomiendo que lean de sus trabajos, marquen las ideas principales y así ir armando el cuadro que tendrá como idea central la palabra "Petróleo".
Deberán hacerlo de forma manual en la carpeta y enviar por mail la foto a gisellabarua@hotmail.com antes del 18/4.